用0.10mol·L-1 NaOH溶液滴定0.10mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是( )
| A.4 | B.7.2 | C.10 | D.11.3 |
下列说法中正确的是()。
| A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子 |
| B.NH3、H2O、CH4分子的几何构型均为三角锥形 |
| C.NH3、H2O、CH4分子中的N、O、C原子均是采取sp2杂化的 |
| D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则下列有关说法中,不正确的是()。
| A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数) |
| B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体 |
C.NH5的电子式为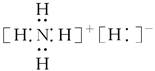 |
| D.它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |
H2O与H2S结构相似,都是V形的极性分子,但是H2O的沸点是100 ℃,H2S的沸点是-60.7 ℃,引起这种差异的主要原因是()。
| A.范德华力 | B.共价键 | C.氢键 | D.相对分子质量 |
下列有关共价键的叙述中,不正确的是()。
| A.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数 |
| B.水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子 |
| C.非金属元素原子之间形成的化合物也可能是离子化合物 |
| D.所有简单离子的核电荷数与其核外电子数一定不相等 |
下列化合物的沸点相比较,前者低于后者的是()。
A.乙醇与氯乙烷

D.H2O与H2Te