300mL硫酸铝溶液中,含铝离子为1.62g,在该溶液中加入0.1mol/L氢氧化钡溶液100mL,反应后溶液中硫酸根离子的物质的量浓度约为
| A.0.4mol/L | B.0.3mol/L | C.0.2mol/L | D.0.1mol/L |
下列实验不能达到目的的是( )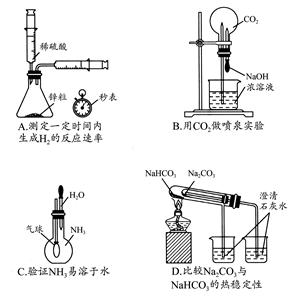
某课外实验小组设计的下列实验不合理的是( )
下列装置所示的实验不能达到目的的是( )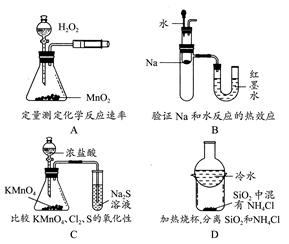
下列实验方案不能达到实验目的的是( )
| 实验目的 |
实验方案 |
|
| A |
证明溴乙烷发生消去反应有乙烯生成 |
向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B |
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
向2 mL 1mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 |
| C |
检验蔗糖的水解产物具有还原性 |
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D |
测定铝箔中氧化铝的含量 |
取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(已转化为标准状况下) |
某同学想利用实验证明高锰酸钾溶液的紫色是MnO4-的颜色,而不是K+的颜色,他设计的下列实验步骤中没有意义的是( )
| A.将高锰酸钾晶体加热分解,所得固体质量减小 |
| B.观察氯化钾溶液没有颜色,表明溶液中的K+无色 |
| C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应 |
| D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫色褪去,表明MnO4-为紫色 |