现有25mL盐酸和硫酸混合溶液,加入2mol/L的氢氧化钠溶液25mL恰好中和,中和后的溶液中加过量的氢氧化钡溶液,所得沉淀质量为3.495g,求:(要求有具体的计算过程)
(1)硫酸钡沉淀的物质的量为
(2)混合溶液中c(HCl)= ,c(H2SO4)= 。
请按下列线条提示,画出Fe、Cu、S、H2、HCl、NaOH、H2So4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl 的树状分类图: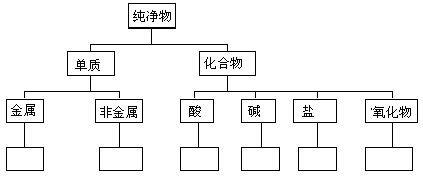
实验室制配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯②100 mL量筒③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码) ⑦滴定管
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是____________。
(2)实验两次用到玻璃棒,其作用分别是:_____________、______________。
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为______________。
有A、B、C、D、E5种元素,已知:
① A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子第三层上的电子比第一层多5个。
② 常温下B2是气体,它对氢气的相对密度是16。
③ C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④ D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1) A是________、B是________、C是________、D是________、E是________。(写元素符号)
(2) E的原子结构示意图为________________,C的离子结构示意图为________________。
(3) F和AB2反应的化学方程式为。
推断元素(以下各题所涉及的元素均在前20号)
①最外层有一个电子的元素是。
②最外层有两个电子的元素是。
③最外层电子数等于次外层电子数的元素是。
④最外层电子数等于次外层电子数两倍的元素是。
⑤最外层电子数等于次外层电子数三倍的元素是。
⑥最外层电子数等于次外层电子数四倍的元素是。
⑦电子层数与最外层电子数相等的元素是。
⑧电子层数为最外层电子数2倍的元素是。
⑨次外层电子数是最外层电子数2倍的元素是。
已知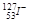 ,求它的Z、N、A、e分别是、、、。
,求它的Z、N、A、e分别是、、、。