在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是 ( )
| A.0.3mol NO、0.1mol NO2 | B.0.3mol NO2 |
| C.0.6mol NO | D.0.3mol NO2、0.1mol NO |
下列各组中的离子,能在溶液中大量共存的有
| A.Na+、H+、CO32-、Cl- | B.Na+、Ba2+、Cl-、SO42- |
| C.K+、 H+、SO42-、OH- | D.Ag+、Al3+、NO3-、H+ |
如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法应该选用下列装置中的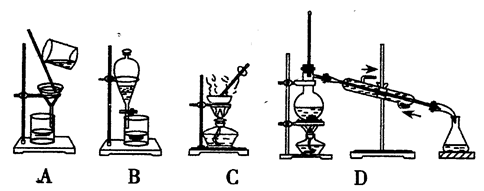
下列叙述正确的是
| A.1 mol CH4的质量为16g/mol | B.H2O的摩尔质量为18 g |
| C.44 g CO2的体积为22.4 L | D.9.8 g H2SO4含0.1NA个H2SO4分子 |
铝具有较强的抗腐蚀能力,主要原因是
| A.铝的化学性质稳定 | B.铝与氧气在常温下不反应 |
| C.铝在任何条件下均不与氧气反应 | D.铝与氧气化合形成一层致密的氧化膜 |
下列关于钠及其化合物的叙述不正确的是
| A.钠是一种灰黑色、具有金属光泽、质地软的金属 |
| B.氧化钠与过氧化钠的颜色不同 |
| C.因为钠的性质非常活泼,故自然界中无游离态钠 |
| D.过氧化钠可以做潜艇的供氧剂 |