黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。

将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2,4FeS + 7O2
2Fe2O3+8SO2,4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
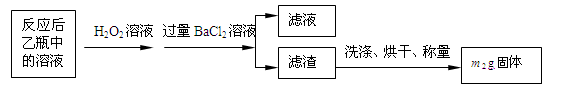
(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________________________________________________________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】:测定铁元素的含量
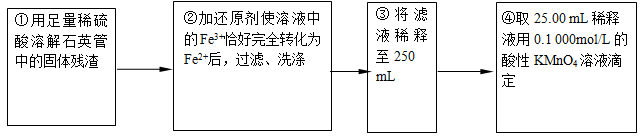
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 消耗KMnO4溶液体积/mL |
25.00 |
25.03 |
20.00 |
24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
(8分)(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_________________ 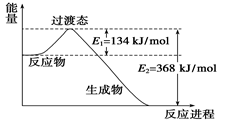
(2)我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下,2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
冰毒(化学名:甲基苯丙胺。苯环上有1个取代基)属于芳香族化合物,分子中只含有碳、氢、氮3种元素,相对分子质量不超过150,碳 元素和氢元素质量分数之和为90.6%。请按要求填空:
元素和氢元素质量分数之和为90.6%。请按要求填空:
(1)冰毒的摩尔质量为:_______________ _____;分子式为:____________________。
_____;分子式为:____________________。
(2)冰毒的同分异构体有很多,写出同时符合下列三项要求的冰毒同分异构体的结构简式
______________________________、______________________________(写出其中的2种)
①苯环上只含有两个相邻的取代基
②分子中含有氨基(-NH2)
③分子中含有两个甲基(-CH3)
异丙苯(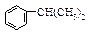 ),是一种重要的有机化工原料。根据题意完成下列填空:
),是一种重要的有机化工原料。根据题意完成下列填空:
(1)由苯与2-丙醇反应制备异丙苯属于__________反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件 为__________________________________________________。
为__________________________________________________。
(2)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的结构简式是
______________________________。
(3)α-甲基苯乙烯(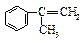 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的化学反应方程式:
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的化学反应方程式:
_________________ ____________________________________________________________。
____________________________________________________________。
(4)耐热型ABS树脂由丙烯腈(CH2=CHCN)、1,3-丁二烯和α-甲基苯乙烯1∶1∶1共聚生成,写出该树脂的结构简式______________________________。
一种烃的碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式___ _______。
_______。
(2)该烃的一氯取代物有__________种。
(3)该烃的二氯取代物有__________种。
(4)该烃的同分异构体有多种,其中1种不能使酸性高锰酸钾溶液或Br2-CCl4溶液褪色,但在一定条件下能跟溴(或H2)发生取代(或加成)反应,这种同分异构体的结构简式是
____________________。
写出下列反应的化学方程式,注明反应类型:
(1)苯与浓硝酸、浓硫酸的混合物反应(60℃):___________________________________;
(2)甲苯制备 三硝基甲苯:_____________________________________________________;
三硝基甲苯:_____________________________________________________;
(3)乙烯与苯反应:__________________ ______________________________________;
______________________________________;
(4)丙烯与水反应生成醇(主要反应):__________________________________________;
反应类型依次是:____________________________________________________________。