设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A.10mL20mol/L浓硫酸与足量锌反应,转移电子数为0.2NA |
| B.0.1mol24Mg18O晶体中所含中子总数为2.0NA |
| C.在标准状况下,2.8gN2和2.24LCO所含电子数均为1.4NA |
| D.1L1mol/L的NaClO溶液中含有ClO-的数目为NA |
已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是
A.N2H4+O 2=N2+2H2O△H=-534.4kJ/mol 2=N2+2H2O△H=-534.4kJ/mol |
| B.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H =-534.4kJ/mol |
| C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = +534.4kJ/mol |
D.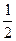 N2H4(g)+ N2H4(g)+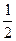 O2(g)= O2(g)=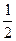 N2(g)+H2O(g)△H =-16.7kJ/mol N2(g)+H2O(g)△H =-16.7kJ/mol |
一定温度下,可逆反应2NO2 2NO+O2在恒容密闭容器中
2NO+O2在恒容密闭容器中 反应,达到平衡状态的标志是:
反应,达到平衡状态的标志是: ①单位时间内生成n mol O2的同时生成2n mol NO2;
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;
④混合气体的颜色不再改变的状态;
⑤密闭容器中压强不再改变的状态;
⑥混合气体 的
的 平均相对分子质量不再改变的状态。
平均相对分子质量不再改变的状态。
| A.①④⑤⑥ | B.②③⑤⑥ | C.①③④⑥ | D.全部 |
反应A+3B=2C+D在四种不同情况下的反应速率分别为:
①v(A) =0.15mol/(L·s)②v(B)=0.6mol/(L·s)③v(C)=0.5mol/(L·s) ④v (D) =0.45mol/(L·s)
则反应进行由快到慢的顺序为:
A.④>③>①>② B.②>④>③>①
C.②>③>④>① D.④>③>②>①
足量的Fe粉与一定量的盐酸反应,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的
A.NaNO3溶液 B.NaCl固体 C.水 D.CuSO4
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.增加C的量 | B.将容器的体积缩小一半 |
| C.保持体积不变,升高温度 | D.压强不变充入N2使容器体积增大 |