下列离子反应方程式书写正确的是( )
| A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.向NaAlO2溶液中通入过量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3+HCO3- |
| C.在强碱溶液中次氯酸钠与氢氧化铁反应生成Na2FeO4: 3ClO2-+2Fe(OH)3=2FeO42-+3Cl-+4H+ |
| D.向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-=Al2S3↓ |
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=- Q1 ;
2H2(g)+O2(g)=2H2O(g) ΔH=- Q2; H2O(g)=H2O(l) ΔH=- Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经
完全燃烧后恢复到常温,则放出的热量为
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |
下列属于放热反应的是
| A.浓硫酸的稀释 | B.铝热反应 |
| C.氢气还原氧化铜 | D.氢氧化钡晶体与氯化铵晶体混合 |
现有常温下水电离出的c(H+)均为1× mol/L的4种溶液:
mol/L的4种溶液:
①HCl溶液;②CH3COOH溶液;③NaOH溶液;④氨水。
有关上述溶液的比较中,正确的是
| A.向等体积溶液中分别加水稀释100倍后,溶液的pH:③>④>②>① |
| B.等体积的①、②、③溶液分别与足量铝粉反应,生成H2的量①最小 |
| C.②、③溶液等体积混合后,溶液显碱性 |
| D.①、④溶液混合若pH=7,则消耗溶液的体积:④>① |
某温度下,向体积为2L的密闭容器中加入CH3OH,发生反应
2CHOH(g)
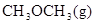 +H2O(g)
+H2O(g) H=-25 kJ·mol
H=-25 kJ·mol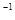 ,反应过程中测定的部分数据见下表。
,反应过程中测定的部分数据见下表。
已知该温度下反应的平衡常数K=400,下列说法正确的是
| 反应时间/min |
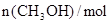 |
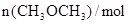 |
| 0 |
2.05 |
0 |
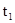 |
0.6 |
|
 |
0.05 |
A.反应在t2 min时 ≠
≠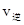
B.反应达到平衡时,放出的热量为50 kJ
C.反应在t1 min内的平均速率为 mol·L
mol·L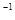 ·min
·min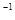
D.若反应达到平衡后,缩小容器体积, 变大
变大
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
KSCN可用来检验 |
用KSCN溶液检验FeSO4是否变质 |
| B |
盐的水解是吸热反应 |
加热可提高盐的水解反应速率 |
| C |
H2O2有氧化性 |
H2O2能使酸性KMnO4溶液褪色 |
| D |
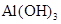 是两性氢氧化物 是两性氢氧化物 |
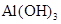 可溶于过量浓氨水中 可溶于过量浓氨水中 |