甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径。由二氧化碳制备甲醇过程中可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) 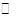 CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
反应Ⅱ:CO2(g)+H2(g)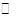 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)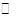 CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅰ自发进行条件是 (填“较低温”、“较高温”或“任意温度”)。
(2)在一定条件下3L恒容密闭容器中,充入一定量的氢气和二氧化碳仅反应反应Ⅰ,实验测得反应物在不同起始投入量下,
体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。
① 氢气和二氧化碳的起始的投入量以A和B两种方式投入
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,曲线Ⅰ代表哪种投入方式 (用A、B表示)
②在温度为500K的条件下,按照A方式充入3摩尔氢气和1.5摩尔二氧化碳,该反应10分钟时达到平衡:A.此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3摩尔氢气和0.9摩尔二氧化碳、0.6摩尔甲醇、x摩尔水蒸气,若使反应在开始时正向进行,则x应满足的条件是 。
b.在此条件下,系统中甲醇的浓度随反应时间的变化趋势如图2所示,当反应时间达到3分钟时,迅速将体系温度升至600K,请在图2中画出3~10分钟内容器中甲醇的浓度变化趋势曲线。

(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应。图3是甲醇燃料电池的模型。
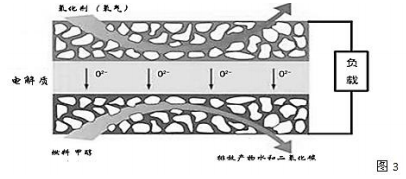
①写出该燃料电池的负极反应式 。
②如果用该电池作为电解装置,当有16g甲醇发生反应时,则理论上提供的电量最多为 摩尔。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
回答下列问题: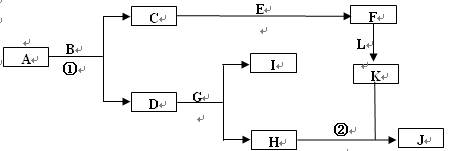
(1)A的电子式。
(2)反应①的化学方程式为,反应②的离子方程式为,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为L。
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)
请回答下列问题:
(1)F的化学式为,H的电子式为,写出反应②的化学方程式;
(2)若A与B均为固体化合物,C是一种能使湿润的红色石蕊试纸变蓝的气体,D是一种中性干燥剂,写出反应①的化学方程式;
(3)若C、D均为常见气体且都能使澄清石灰水浑浊,则A是,B是(写化学式);
(4)若A、C、D均含有氯元素,且A的化合价介 于C、D之间,B、C、D中均含有钾元素,写出常温时①的离子方程式:。
于C、D之间,B、C、D中均含有钾元素,写出常温时①的离子方程式:。
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用。
(1)右图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/℃ |
25 |
125 |
225 |
… |
| K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
… |
完成下列问题:
①比较K1、K2的大小:K1K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是(填序号)。
A. |
B. |
| C.容器内压强保持不变 | D.混合气体的密度保持不变 |
在①CH2=CH2② ③CH3CH2OH④CH3COOH⑤聚乙烯五种物质中:
③CH3CH2OH④CH3COOH⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是(请填物质的序号,下同。)
(2)属于高分子化合物的是;
(3)能与Na2CO3溶液反应 的是;
的是;
(4)能发生酯化反应的是;
(5)既能发生取代反应又能发生加成反应的是。