实验题
I.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①完成此实验设计,其中:V1= ,V6= ,V9=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
Ⅱ、某兴趣组进行下列实验测定某稀硫酸的质量分数,选用酚酞做指示剂。
操作①:取5.00 mL稀H2SO4溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释;
操作②:用0.1000 mol/LKOH标准溶液滴定;
操作③:用同样方法滴定,4次消耗KOH溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、20.40 mL。
请回答下列问题:
(4)如何判定滴定终点:______________________________________________。
(5)在上述实验中,下列操作会造成测定结果偏高的有________(填序号)。
A.锥形瓶用待测液润洗
B.量取稀H2SO4溶液的滴定管用蒸馏水洗净,未用稀H2SO4溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(6)分析数据,计算稀H2SO4溶液中溶质的质量分数为_________ (保留三位有效数字)。
七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4•7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .
氨在人类的生产和生活中有着广泛的应用.某化学兴趣小组利用图一装置探究氨气的有关性质。
(1)装置A中烧瓶内试剂可选用 (填序号).B的作用是 .
a.碱石灰 b.生石灰 c.浓硫酸 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 .该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成1L溶液,所得溶液的物质的量浓度为_______mol/L.
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
(2)实验装置(如图所示):
(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。③待反应进行完全后,关闭活塞K1,打开活塞 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。④ (填入该步应进行的操作)。⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
③AlN的质量分数为 。
二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料。从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式 。
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间、熔块粉碎外,适宜的条件还可以选择 (任写一种)。
(3)过滤时所需玻璃仪器为漏斗、玻璃棒和烧杯。从滤液中得到X为绿矾(FeSO4·7H2O)晶体的实验操作依次为:加热浓缩、冷却结晶、过滤洗涤、低温干燥。实验室要配制、保存该溶液时需加少量铁屑,目的是 。
(4)第③步反应化学方程式 。
(5)若实验时需要450mL2mol/L的C溶液,则在精确配制时,需用托盘天平称取NaOH固体 g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒、胶头滴管、药匙外,还必须有 (填仪器名称)。
[实验化学]
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。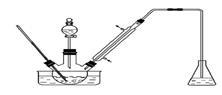
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_______________,锥形瓶中的溶液应为_______________。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为________________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的_____________ (填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是________________。
(5)步骤4中采用减压蒸馏技术,是为了防止____________。
附表相关物质的沸点(101kPa)
| 物质 |
沸点/℃ |
物质 |
沸点/℃ |
| 溴 |
58.8 |
1,2-二氯乙烷 |
83.5 |
| 苯甲醛 |
179 |
间溴苯甲醛 |
229 |