某矿样的主要成分为Al2O3和SiO2。现以该矿样为原料制备氧化铝和高纯硅的流程如下:
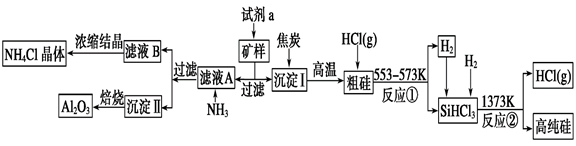
请回答下列问题:
(1)试剂a的最佳选择为________(填代号)。
a.稀盐酸 b.氨水 c.纯碱溶液 d.醋酸
(2)由沉淀Ⅱ获得Al2O3,用到的实验仪器除了酒精灯、泥三角、玻璃棒和铁三脚外,还需要的两种仪器是____________________________(填写仪器名称)。
(3)滤液A中通入NH3后发生反应的离子方程式为____________________________。
(4)NH4Cl是一种常用化肥的主要成分。现有一包肥料可能是NH4Cl或(NH4)2SO4中的一种,请设计实验进行鉴别(简述操作过程) ___________________________________。
(5)如图所示实验装置,在实验室中制取氨气可选用装置____________,氨气的干燥应选用装置________(选填代号)。

根据下面的反应线路及所给信息填空。
(1)A的结构简式是,B的结构简式是
(2)①的反应类型是;③的反应类型是;
(3)反应④的条件是;
(4) 写出反应②的化学方程式___________________________。
(12分)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
(1)写出有机物(a)的系统命名法的名称_____________________________ __.
(2)有机物(a)有一种同分异构体,试写出其结构简式_________________________.
(3)上述有机物中与(c)互为同分异构体的是__________(填代号).
(4)任写一种与(e)互为同系物的有机物的结构简式________.
(5)上述有机物中不能与溴水反应使其褪色的有________(填代号).
(6)(a)(b)(c)(d)(f)五种物质中,4个碳原子一定处于同一平面的有________(填代号).
(11分)(1)已知丙酮[ CH3COCH3 ]键线式可表示为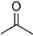 根据键线式回答下列问题:
根据键线式回答下列问题:
(1) 分子式:,结构简式:。
分子式:,结构简式:。
(2)写出乙烯分子的电子式:。
(3)有机物(CH3)2CHCH(C2H5)CH=CH2的名是。
(4)写出甲苯制TNT化学方程式。
(5)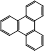 的一氯取代物有种,
的一氯取代物有种,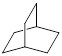 的二氯取代物有种。
的二氯取代物有种。
在一个容积固定的反应容器中有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应:
A、B、C、D、E、F的起始加入量分别为2mol、1mol、0mol、Xmol、Ymol、Zmol,两边反应达平衡后,隔板恰好在正中间位置。
(1)恒温时,若向左边容器中再充入0.3 mol He,则右边容器内的平衡移动(填“向左”“向右”或“不”);
(2)恒温时,若向左边容器中通入的不是He,而是2molA和1molB的气体,与原平衡相比,左边容器中C的体积分数(填“增大”“减小”或“不变”,下同),右边容器中气体平均相对分子质量;
(3)恒温时,在(2)题的平衡体系中,若向左右两容器中同时再各注入1molHe,平衡后与(2)题的原平衡体系相比,下列说法正确的是(填序号)。
A、C、F的浓度都不变
B、B的转化率、F的分解率均增加
C、A、D物质的量都增加了
D、A、B、C、D、E、F物质的量都不变
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的固体产物具有两性。
(1)若稀硝酸腐蚀锌板产生的气体N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式。
(2)在操作①中保持pH=8的目的是。
(3)沉淀I的主要成分是。
(4)操作③中加热、煮沸的目的是;
此步骤操作的理论依据是。
(5)操作④保持pH=2的目的是;
此步骤操作中所用的仪器有带铁圈铁架台、酒精灯、、。