下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO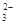 )+c(HCO
)+c(HCO )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH)=l0-a mol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)-c(H2S)-c(HS-)
| A.①④ | B.②⑤ | C.①③ | D.②④ |
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:
| A.H2O2 | B.IO3- | C.MnO4- | D.HNO3 |
已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是()
| A.2W- + Z2 = 2Z- +W2 | B.2X- + Z2 = 2Z- + X2 |
| C.2Y- + Z2 = 2Z- + Y2 | D.2Z- + X2 = 2X- + Z2 |
有一未完成的离子方程式: +XO3-+6H+===3X2+3H2O,据此判断X元素的最高化合价为 ( )
+XO3-+6H+===3X2+3H2O,据此判断X元素的最高化合价为 ( )
| A.+7 | B.+6 | C.+5 | D.+1 |
下列叙述中,正确的是( )
| A.含金属元素的离子一定是阳离子 |
| B.在氧化还原反应中,非金属单质一定是还原剂 |
| C.某元素从化合态变为游离态时,该元素一定被还原 |
| D.金属阳离子被还原不一定得到金属单质 |
已知:Ni+CuSO4=NiSO4+Cu Cu+2AgNO3=Cu(NO3)2+2Ag 则下列判断正确的是( )
| A.还原性:Ni>Cu>Ag |
| B.氧化性:Ni2+ >Cu2+ >Ag+ |
| C.还原性:Ni<Cu<Ag |
| D.还原性:Ni2+ <Cu2+ <Ag+ |