下列说法正确的是( )
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 |
| B.有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数 |
| D.催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率 |
常温下,0.1mol·L-1某一元酸(HA)溶液pH = 3,下列叙述正确的是( )
①该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
②用pH=3的HA溶液与pH=4的HCl溶液分别中和等浓度等体积的氢氧化钠溶液所耗去酸液的体积分别为V1和V2,其关系为10V1<V2
③pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)=c(A-)+c(HA)
④0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中 2c(H+)+c(HA)=c(A-)+2c(OH-)
A .①B .②③C.②④D.③④
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )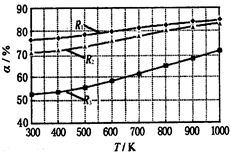
| A.该反应△H > 0 |
| B.R1对应的反应物配比为3:1 |
| C.650℃,反应物配比为1:1时,平衡常数K = 6 |
| D.该反应为取代反应 |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是()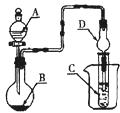
| A.若A为水,B为Al2S3固体,C中盛硫酸铜溶液,则C中有黑色沉淀生成 |
| B.若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C.若A为浓氨水,B为碱石灰,C中盛氯化铝溶液,则C中溶液先出现白色浑浊后澄清 |
| D.若A为浓硫酸,B为铜,C中盛石蕊试液,则C中溶液褪色 |
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述错误的是( )
| A.分子式为C23H36O7 |
| B.能使酸性KMnO4溶液褪色 |
| C.能发生加成,取代,水解,聚合,氧化反应 |
| D.1 mol 该物质最多可与1 mol NaOH 反应 |
下列解释事实的离子方程式正确的是( )
| A.向明矾溶液中加入氢氧化钡溶液至沉淀质量最大Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
| B.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH- =CaCO3↓+H2O |
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O 2OH- +Cl2↑+ H2↑ 2OH- +Cl2↑+ H2↑ |
| D.NaClO溶液中通入少量的SO2:ClO-+H2O+SO2=Cl-+SO42-+2H+ |