对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) 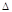 H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) 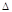 H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) 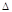 H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 _。
(2)氨气是化工生产的主要原料之一,在一固定容积为2L的密闭容器内加入0.2 mol N2和0.5mol H2,发生如下反应: N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
①当反应进行到第5分钟时达到平衡,测得NH3的浓度为0.1mol/L 则从反应开始到平衡时,v(N2)为______________
②下列描述中能说明上述反应已达平衡的是
A.容器内的总压强不再随时间而变化
B.混合气体的密度不再随时间变化
C.a molN≡N键断裂的同时,有6amolN—H键生成
D.N2、H2、NH3的分子数之比为1∶3∶2
E.3V正(H2)=2V逆(NH3)
F.容器中气体的平均分子量不随时间而变化
③若保持反应温度不变,再向容器中充入N2和NH3各0.1mol , 则化学平衡将 移动(填“向左”、“向右”或“不”)
④平衡后,下列措施既能提高该反应的速率又能增大N2的转化率的是( )
A.充入N2 B.升高温度 C.向原容器内继续充一定量NH3 D.增大压强
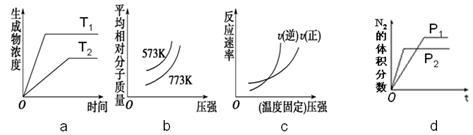
⑤若保持容器体积不变,下列图像正确的是( )
17.(共6分)金属Na、Mg、Al有广泛的应用。
(1)周期表中Na、Mg、Al所在周期是。
(2)为比较Na、Mg、Al的金属性,进行了如下实验:
实验1:各取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢。
实验2:各取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈。
已知:元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度来判断。
由实验1和实验2得出的结论是,用原子结构理论解释:同周期元素从左到右,。
(3)Na、Mg、Al都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应的化学方程式是。
21.在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如下图: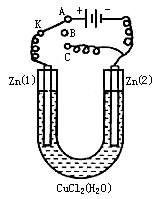
(1)如果把电键K接A,这一装置形成电解池装置,____是阳极,其电极反应式是_________________;
(2)上述反应进行5min后,转换电键K到C,这一装置形成原电池装置,________极是负极,该装置发生反应的总化学方程式是______________
(3)上述装置进行2min后,再转换电键K到B,在极上发生的腐蚀属于腐蚀。
20.已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp_______(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是___________ (用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于(已知Ksp[Cu(OH)2]=2.0×10-20)。
19.(1)有下列物质:①铜 ②硫酸钡固体 ③氨水 ④氢氧化钠固体 ⑤熔融硝酸钾;
⑥乙醇; ⑦稀硫酸; ⑧金刚石; ⑨二氧化硫 ; ⑩冰醋酸。
属于非电解质的有_____;属于强电解质的有_____;(填序号)
(2)常温下,将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈性,溶液中c(NH4+)与c(Cl-)的大小关系是:c(NH4+)c(Cl-);(填>,<或=)
(3)常温下,0.010mol·L-1盐酸和0.010mol·L-1氨水的pH之和14,常温下,pH=2的盐酸和pH=12的氨水,分别加水稀释10倍后,两溶液的pH之和14(填>,<或=)
18.甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)=CH3OH(g)
请根据下图回答下列问题: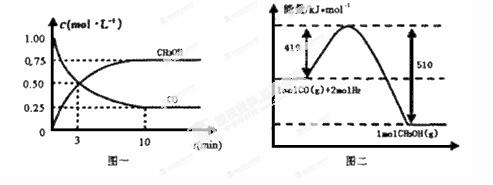
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=____mol / (L·min)。
(2)写出该反应的热化学方程式_____________________________________________________
(3)恒容条件下,下列措施中能使 n(CO) /n(CH3OH)增大的有。
A.升高温度B.充入He气
C.再充入1 mol CO和2 mol H2D.使用催化剂
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化(Q1、Q2、Q3均大于0) |
| 甲 |
1 mol CO和2 mol H2 |
a1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
a2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4 mol H2 |
a3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是:
A. c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1+ a3=1
E.该反应若生成1 mol CH3OH,则放出(Q1+ Q2)kJ热量
(5)若在一体积可变的密闭容器中充入1molCO、2mol H2和1mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向(填“正”、“逆”)反应方向移动,理由是由质量守恒,密度为原来的1.6倍,所以体积缩小,平衡正移。