硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
为测定某有机化合物A的结构,进行如下实验。
【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下)。则该物质中各元素的原子个数比是;
(2)质谱仪测定该有机化合物的相对分子质量为46,则该物质的分子式是;
(3)根据价键理论,预测A的可能结构并写出结构简式:。
【结构式的确定】
(4)经测定,有机物A分子内有3种氢原子,则A的结构简式为。
【性质实验】
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式:。
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应的方程式:。
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式:。
如图为硬脂酸甘油酯在碱性条件下水解的装置。进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g氢氧化钠、5 mL水和10 mL酒精。加入酒精的作用为。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入(填化学式),静置一段时间,溶液分为上下两层,肥皂在层,这个操作称为。
(4)图中长玻璃导管的作用为。
(5)写出该反应的化学方程式。
(1)1 mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2 L(标准状况)氢气,则A分子中必有一个基,若此基在碳链的一端,且A中无支链,则A的结构简式为。
(2)A与浓硫酸共热,分子内脱去1分子水,生成B,B的结构简式为;B通入溴水中能发生反应,生成C,C的结构简式为。
(3)A在铜作催化剂时,与氧气在加热条件下发生氧化还原反应生成D,D的结构简式为。
写出下列指定反应的化学方程式:
①A→B;
②B→C;
③A→D。
生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为(不用写反应条件),原子利用率是。
(3)下列属于乙醇的同系物的是,属于乙醇的同分异构体的是。(选填编号)
A.
B.
C.乙醚
D.甲醇
E.CH3—O—CH3
F.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
①46 g乙醇完全燃烧消耗mol氧气。
②乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为。
③下列说法正确的是(选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯
有机物A可作为植物生长调节剂,为便于使用,通常将其制成化合物D(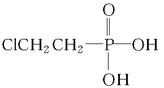 ),D在弱酸性条件下会缓慢释放出A。合成D的一种方法及各物质间的转化关系如下图所示:
),D在弱酸性条件下会缓慢释放出A。合成D的一种方法及各物质间的转化关系如下图所示: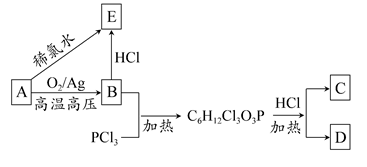
请回答下列问题:
(1)A的名称是,A与氯气反应可生成C,C的名称是;
(2)经测定E中含有氯元素,且E可以与乙酸发生酯化反应,则E的结构简式为,由A直接生成E的反应类型是;
(3)在弱酸性条件下,D与水反应生成A的化学方程式为;
(4)写出E的两种同分异构体的结构简式:。