25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是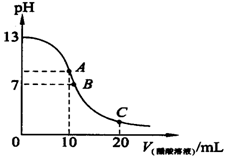
| A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+) |
| B.在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+), |
| C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-) |
| D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+) |
对于反应COCl2(g) CO(g)+Cl2(g) ΔH=-QkJ·mol-1(Q>0)化学平衡常数为K 则下列叙述正确的是:
CO(g)+Cl2(g) ΔH=-QkJ·mol-1(Q>0)化学平衡常数为K 则下列叙述正确的是:
| A.一定条件下,该反应在任何温度下均能自发进行 |
B.反应CO(g)+Cl2(g)  COCl2(g) ΔH=" +Q" kJ·mol-1化学平衡常数为K COCl2(g) ΔH=" +Q" kJ·mol-1化学平衡常数为K |
C.反应2COCl2(g) 2CO(g)+2Cl2(g) 化学平衡常数为2K 2CO(g)+2Cl2(g) 化学平衡常数为2K |
| D.将1mol COCl2 (g)置于一密闭容器中充分反应后放出QkJ的热量 |
对已达化学平衡的下列反应 2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是:
2Z(g),减小压强时,对反应产生的影响是:
| A.逆反应速率增大,正反应速率减小 |
| B.逆反应速率减小,正反应速率增大 |
| C.逆反应速率先增大后减小 |
| D.正反应速率先减小后增大 |
下列说法错误的是:
| A.工业上采用电解熔融氯化铝制取金属铝 |
| B.牺牲阳极的阴极保护法实际上是利用原电池原理 |
| C.将钢闸门与外电源负极相连,可防止其腐蚀 |
| D.铅蓄电池充电时,铅电极与直流电源的负极相接 |
将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是: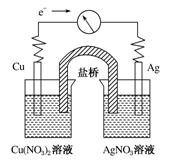
| A.KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B.Cu作负极,发生还原反应 |
| C.电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 |
| D.工作一段时间后,AgNO3溶液中c(Ag+)减小 |
对于可逆反应:2SO2+O2 2SO3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是:
2SO3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是:
| A.增大压强 | B.升高温度 | C.使用催化剂 | D.充入O2 |