已知:25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
Ba2+对人体有毒,医学上进行消化系统X射线透视时,常用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是:
__________________________________________________________。
万一误服了少量BaCO3,应尽快用大量0.5 mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为__________mol/L。
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。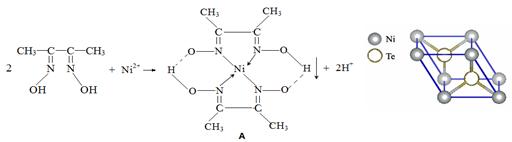
(1)基态Ni原子的价层电子排布式为。
(2)丁二酮肟组成元素中C、N、O的第一电离能由小到大的顺序为。
丁二酮肟分子中C原子轨道的杂化类型是。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式。
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石( Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH |
完全沉淀时的pH |
|
| Fe3+ |
2.7 |
3.7 |
| Y3+ |
6.0 |
8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸和下列选项中的试剂(填字母代号),
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
再通过操作方可实现(填实验操作名称)。
②写出Na2BeO2与足量盐酸发生反应的离子方程式:;
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在
的范围内;继续加氨水调节pH =b发生反应的离子方程式为,溶液中Fe3+完全沉淀的判定标准是。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热(填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为[25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)]。
(6)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C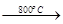 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
①若在实验室中煅烧硫酸镁,需要的仪器除酒精灯、三脚架以外,还需要。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
②用下列实验装置检验煅烧产生的气体中含有SO2、CO2气体(加热装置略去,部分装置可以重复使用)。
正确的连接顺序是a→b→(按接口连接)。B中盛放的试剂是,确定存在二氧化碳气体的实验现象是。
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O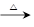 乙+丙 b.乙
乙+丙 b.乙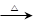 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是:;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为(选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为。
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①写出上述反应的化学方程式。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为。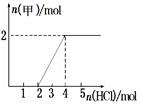
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g)ΔH= + 67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g)ΔH= - 534.0kJ·mol-1
2NO2(g)  N2O4(g)ΔH=" -" 52.7kJ·mol-1
N2O4(g)ΔH=" -" 52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为:;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)ΔH= Q kJ·mol-1
4NH3(g)+3O2(g)ΔH= Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
E.若向容器中继续加入N2,N2的转化率将增大
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)c(NO3-)(填“>”“<”或“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为。