【化学——选修3:物质结构与性质】
铁是最常见的金属材料。铁能形成 [Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物。
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(4)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3。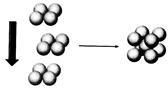
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
①加入试剂a后发生反应的离子方程式为。
②操作b为,操作c为。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在范围内(填字母序号)。
| 物质 |
Na |
S |
Al2O3 |
| 熔点/℃ |
97.8 |
115 |
2050 |
| 沸点/℃ |
892 |
444.6 |
2980 |
a.100℃以下 b.100℃~300℃ c.300℃~350℃ d.350℃~2050℃
②放电时,电极A为极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx="2Na" + xS(3<x<5),则阳极的电极反应式为。
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: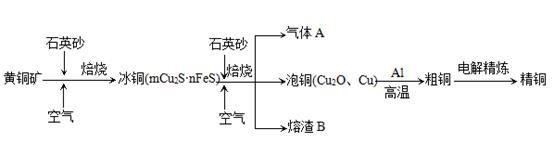
(1)气体A中的大气污染物可选用下列试剂中的_______
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在(填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为。
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。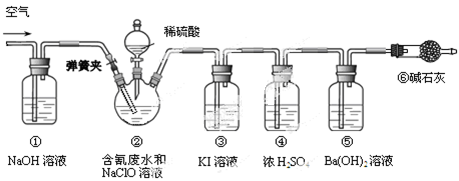
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是。
(2)装置②中,生成需由装置③除去的物质的离子方程式为。
(3)反应结束后,缓缓通入空气的目的是。
(4)为计算该实验中含氰废水被处理的百分率,需要测定的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。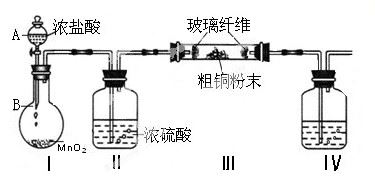
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是。
④装置Ⅳ中盛装的试剂是,其作用是。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系: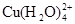 (aq) +4Cl-(aq)
(aq) +4Cl-(aq)
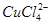 (aq) +4H2O(l)
(aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a.b。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是。
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: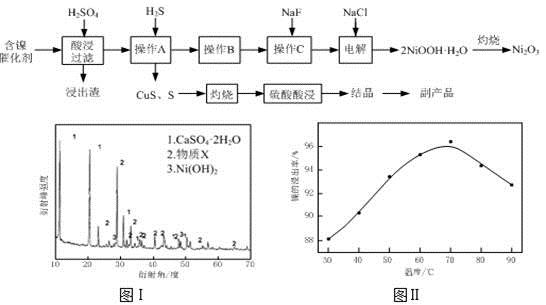
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是。
(2)工艺流程中“副产品”的化学式为。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下��验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为。