短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。Z原子的最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍。X与Y、Z位于相邻的周期。下列说法正确的是
| A.X的最高价氧化物对应的水化物是弱酸 |
| B.Z位于元素周期表的第3周期第ⅥA族 |
| C.Y的最高氧化物对应的水化物能溶于NaOH溶液 |
| D.原子半径的大小顺序:r(Z)>r(Y)>r(X) |
下列有关金属的说法正确的是()
A.金属原子的核外电 子在金属晶体中都是自由电子 子在金属晶体中都是自由电子 |
| B.金属导电的实质是金属阳离子在外电场作用下的定向移动 |
| C.金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D.镁型和铜型的原子堆积方式空间利用率最高 |
SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是
A.SO42-的电子式为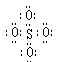 |
B.S2O82-中没有非极性键 |
| C.S2O82-比SO42-稳定 | D.S2O82-有强氧化性 |
x、y为短周期元素,x原子K、L、M各电子层的电子数之比为1:4:1,它比y原子多3个电子,下列叙述正确的是( )
| A.x离子半径大于y离子半径 |
| B.x单质在空气中燃烧可生成两种化合物 |
| C.x、y形成的化合物与浓硫酸共热可在烧瓶中进行 |
| D.电解x、y形成的化合物的水溶液可得到y单质 |
已知AB、CD、EF均为1: l型离子化合物,根据下列数据判断它们的熔点由高至低的是 ( )
| 离子化合物 |
AB |
CD |
EF |
| 离子电荷数 |
1 |
1 |
2 |
| 键长(10-10m) |
2.31 |
3. 18 |
2.10 |
A.CD>AB>EFB.AB>EF>CD C.AB>CD>EFD.EF>AB>CD
下列关于杂化轨道的叙述中,正确的是()
| A.分子中中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构 |
B.CuSO4中氧原子杂化类型 有两种,分别为sp2 和sp3杂化 有两种,分别为sp2 和sp3杂化 |
| C.[Cu(NH3)4]2+和CH4两个分子中中心原子Cu和C分别是通过sp2 和sp3杂化轨道成键 |
| D.杂化轨道可用于形成σ键或用于形成π键 |