NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A.1mol FeCl3完全水解生成NA个胶体粒子 |
| B.常温常压下,23g NO2分子总数小于0.5NA |
| C.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA |
| D.6.8g熔融态KHSO4中含有0.1NA个阳离子 |
下列叙述不正确的是
| A.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
| B.CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液 |
| C.根据金属活动性顺序表,可以推断冶炼金属时可能的方法 |
| D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |
某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
下列有关推断合理的是
| A.根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B.沉淀H为Al(OH)3、BaCO3的混合物 |
| C.溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D.若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)="0.05" mol·L-1 |
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.使用该漂白剂的最佳pH为3 |
| D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有则c(HClO2)+ 2c(H+)=c(ClO2-)+ 2c(OH-) |
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式 。下列说法不正确的是
。下列说法不正确的是
| A.充电时Li+从右边流向左边 |
| B.放电时,正极锂的化合价未发生改变 |
| C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
下列说法正确的是
A.化合物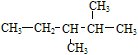 按系统命名法的名称为3,4-二甲基戊烷 按系统命名法的名称为3,4-二甲基戊烷 |
| B.淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 |
| C.通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 |
| D.等质量的聚乙烯、甲烷、乙烯分别充分燃烧,所耗氧气的量依次减少 |