随着原子序数的递增,八种短周期元素原子半径的相对大小和最高正价或最低负价,如图所示。

(1)元素Z位于元素周期表的第 周期 族,X与Z可形成18电子的化合物,该化合物的电子式为 。
(2)非金属性: Y (填“ >”或“<”)D。
(3)单质F与EDX溶液反应的化学方程式为 。
(4)G和H可形成一种化合物,其相对分子质量在90〜110之间,且G的质量分数约为31.1%,该化合物的化学式为 。
H2A(酸):K1=4.310-6,K2=2.110-9。H2B(酸):K1=1.010-4,K2=6.310-8,在浓度相同的对应溶液中,用“>”、“<”或“=”填空。
(1)中和同浓度、同体积NaOH溶液时的用量:H2A溶液________H2B溶液;
(2)c (Na+):Na2A溶液________Na2B溶液;
(3)pH:H2A溶液________H2B溶液;
(4)酸分子的浓度:NaHA溶液________NaHB溶液;
(5) 酸根离子的浓度:NaHA溶液________NaHB溶液;
如下图为相互串联的甲、乙两电解池。试回答: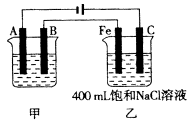
(1)若甲电解池利用电解原理在铁上镀银,则B是(填电极材料),电极反应为,甲中电解质溶液的溶质为__________。
(2)若甲电解池某极增重4.32g,则乙槽中Fe极上放出的气体在标准状况下的体积是__________mL。
(3)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于__________。
下表是老陈的血液化验单部分内容。
| 项目名称 |
血液中的含量(mmol·L-1) |
| 钾 |
3.91 |
| 甘油三酯 |
0.99 |
| 葡萄糖 |
3.00 |
| 低密度蛋白质 |
2.96 |
已知:1摩尔(mol)等于1000毫摩尔(mmol),正常人的血液中葡萄糖(简称血糖,分子式为C6H12O6)的浓度在0.70—1.15g·L-1之间,据此回答下列问题:
计算老陈1mL血液中含葡萄糖g,血糖属(填“正常”、“偏高”或“偏低”)。
(6分)已知某待测液由Ag+、Mg2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据以上实验现象可知,该瓶溶液中一定含有离子,一定没有离子,可能有离子。
第63届联合国大会通过决议,将2011年定为“国际化学年”,其主题是“化学——我们的生活,我们的未来”,以纪念化学学科所取得的成就及对人类文明的贡献。请回答下列问题:
(1)工业上生产玻璃、水泥和炼铁都要用到的原料是(填名称),工业炼铁主要设备是。
(2)工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是(填化学式)。
(3)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路板时,要用FeCl3溶液作为“腐蚀液”。
①写出FeCl3溶液“腐蚀”铜箔的离子方程式。
②某化学兴趣小组为分析某厂家腐蚀以后所得混合溶液组成,试探性地向100 mL腐蚀后的混合溶液中加入2.80g铁粉,结果全部溶解且未见固体析出。则混合溶液的组成为(填写化学式):。