金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
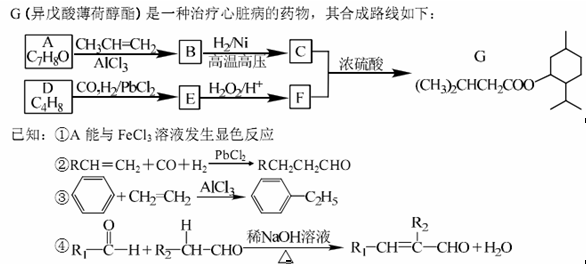
(1) A的名称为____
(2) G中含氧官能团名称为____
(3) D的分子中含有____种不同化学环境的氢原子
(4) E与新制的氢氧化铜反应的化学方程式为____
(5)写出符合下列条件的A的所有同分异构体的结构简式:____
A.分子中有6个碳原子在一条直线上:b.分子中含--OH
(6)正戊醇可用作香料、橡胶促进剂等,写出以乙醇为原料制备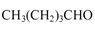 的合成路线流
的合成路线流
程图(无机试剂任用)。合成路线流程示意图示例如下:
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个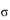 键:
键:
HNO2的酸性比HN03弱是因为_____
(4)亚硝基钻钠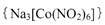 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的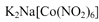 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。
①基态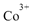 的价层电子排布图为_____
的价层电子排布图为_____
②用亚硝酸钻钠检验K+的离子方程式是
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d.不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的 都看作
都看作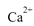 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的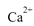 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
A.将水加热煮沸 B.加入适量的Na3P04
C.加入过量的稀盐酸 D.将水通过磺化煤
(4)工业上采用硫化钠一石灰铁盐法除去含砷废水(砷的主要存在形式为H3ASO3的主要工艺
流程如下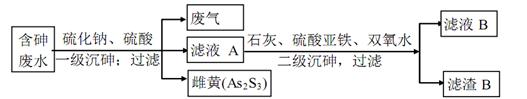
已知:a.亚砷酸(H3As03)还原性较强,易被氧化为砷酸(H3AsO3)
B.亚砷酸盐的溶解性大于相应的砷酸盐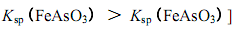
请回答以下问题:
①废气的主要成分为____
②写出一级沉砷过程中生成雌黄的离子方程式:______
③滤渣B的主要成分有_____〔写两种,用化学式表示)
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
(1)提出假设
猜想①:白色不溶物可能为___
猜想②:白色不溶物可能为MgCO3
猜想③:白色不溶物可能是碱式碳酸镁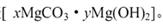
(2)定性实验
(3)定量实验:
称取实验I中所得干燥、纯净的白色不溶物14.2 g,充分加热至不在产生气体为止,并使分解
产生的气体全部通入如下装置中: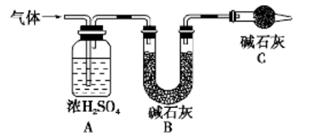
①实验测得装置A增重1.8 g,装置B增重4.4 g,则白色不溶物的化学式为_____
②装置C的作用为____,若移除装置C会导致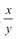 的值___(填“偏大”、“偏小”或“不变”
的值___(填“偏大”、“偏小”或“不变”
(4)探究原理
①请结合化学用语和化学平衡移动原理解释Mg与饱和NaHC03溶液反应产生大量气泡和白
色不溶物的原因:_______
②250C时,测得Mg与饱和NaHC03溶液反应所得混合体系的pH为10,则该体系中
为(已知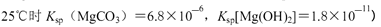
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是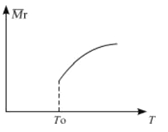
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在___(填"T1”、“T2”.,“T3”)温度下反应达到平衡所需时间最长:
假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCl) =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下: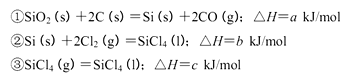
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____