莫尔盐[(NH4)2Fe(SO4)2·8H2O]溶液经常用于定量滴定实验。下列有关说法正确的是
| A.配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐19.6克 |
| B.可与含Fe2+、HClO、H+、Cl-微粒的溶液大量共存 |
| C.加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓ |
| D.取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+ |
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是()
| A.950mL,201.4g | B.1000mL,212g |
| C.任意规格,572g | D.500mL,106g |
使等体积的AlCl3.CaCl2.NaCl溶液中的Cl-完全转化为AgCl沉淀,所用0.1 mol/L AgNO3溶液的体积相同,则这三种溶液的物质的量浓度之比为( )
| A.1:2:3 | B.1:1:1 | C.2:3:6 | D.6:3:2 |
有一真空瓶质量为 ,该瓶充入空气后质量为
,该瓶充入空气后质量为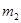 。在相同状况下,若改为充入某气体A时,总质量为
。在相同状况下,若改为充入某气体A时,总质量为 。则A的相对分子质量是()
。则A的相对分子质量是()
A. ×29 ×29 |
B. ×29 ×29 |
C. ×29 ×29 |
D. ×29 ×29 |
两个体积相同的密闭容器一个盛有氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的 ()
| A.质量 | B.原子总数 | C.电子总数 | D.质子总数 |
下列仪器常用于物质分离的是
① ② ③ ④ ⑤ ⑥
| A.②⑤⑥ | B.②③⑤ | C.②④⑤ | D.①③⑥ |