用NaCl固体来配制500mL、0.2mol·L-1的NaCl溶液.可供选择的仪器有:①玻璃棒、②烧瓶、③烧杯、④胶头滴管、⑤量筒、⑥500mL容量瓶、⑦托盘天平、⑧药匙.请回答下列问题:
(1)在配制溶液时用到的仪器有__________________(填代号).
(2)经计算,需称取NaCl固体的质量为__________________g.
(3)将NaCl固体溶解后,冷却片刻,随后全部转移到_______mL的容量瓶中,转移时应用玻璃棒_________.转移完毕,用少量蒸馏水洗涤_______________2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度________________处改用_____________加蒸馏水到瓶颈刻度的地方,使溶液的_______________________________,振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其它操作都准确,下列操作中能引起误差偏高的有__________(填代号).
①转移前,容量瓶中含有少量蒸馏水
②所用过的烧杯、玻棒未洗涤
③定容时,俯视标线观察
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
本题含两小题,共14分。
(1)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将Au2O3之外的物质分别填如以下空格内,配平后标出电子转移的方向和数目。
②反应中,被还原的元素是,还原剂是。
③纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,,则还原剂与氧化剂物质的量之比为
。
(2)按要求写出有水参与的氧化还原反应的化学方程式
①水是氧化剂:
②水是还原剂:
③水既不是氧化剂也不是还原剂:
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
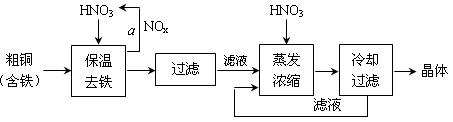
①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至 30℃以下,可能析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;
Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
|




|
有关的离子反应方程式为
(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。| 实验次数 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
| ① |
30 |
5 |
0 |
85 |
2 |
3.8 |
| ② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
| ③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
| ④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
| ⑤ |
30 |
5 |
0 |
55 |
2 |
10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验 和 证明物质D的用量越大,反应速率越快。
(6)写出步骤①中发生反应的化学方程式 ,____________________
X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1 molX
水解得到1 mol Y和1 mol CH3CH2OH,X、Y的分子量都不超过200,完全燃烧都只生成
CO2和H2O。且X分子中碳和氢元素总的质量百分含量约为81.8%。
(1) X、Y分子量之差为 。
(2)1个Y分子中应该有 个氧原子。
(3) X的分子式是_________ ______。
(4) G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下: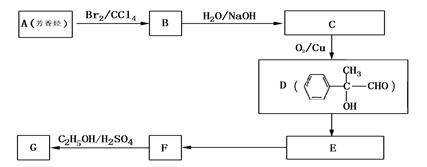
①写出A的结构简式
② E→F的反应类型是 反应,该反应的化学方程式为: 。
③写出所有符合下列条件的F的同分异构体的结构简式:
ⅰ.分子内除了苯环无其他环状结构,且苯环上有2个对位取代基。
ⅱ.一定条件下,该物质既能与银氨溶液发生银镜反应又能和FeCl3溶液发生显色反应。
。
常温下Ca(OH)2的Ksp=5.5×10-6,KspAg2SO4=" 1.2" ×10-5,KspAgCl=1.56×10-10,现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+ 阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
④在D溶液中滴加BaCl2溶液未看到白色沉淀
根据上述实验现象,回答下列问题:
(1)写出下列化合物的化学式:ACDE
(2)写出③中白色絮状沉淀变成红褐色过程中发生的化学反应方程式
(3)小骐同学欲将B、F混合,不小心将B、F倒入了稀盐酸中,马上看到有白色沉淀,你认为此白色沉淀中一定有,该同学还可以看到另一个现象,用离子方程式解释产生原因。