原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,Y2X2分子中σ键和π键个数比为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为 。
②W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于 (填晶体类型),该晶体中W的化合价为 。
(5)下列有关的说法正确的是 。
| A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
| B.电负性顺序:X<Y<Z<Q |
| C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 |
| D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸 |
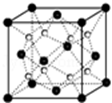
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。

请用化学用语回答下列问题: (1)D元素在周期表中的位置:
(1)D元素在周期表中的位置:
(2)A、D、E元素简单离子半径由大到小的顺序为_____>______>______(填微粒符号) (3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式 ,该阳离子中存在的化学键有 。 (5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(6) 化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
(7)在Fe和Cu的混合物中加入一定量C的最高价氧化物的水化物稀溶液,充分反应后,剩余金属m1 g;再向其中加入稀硫酸,充分反应后,金属剩余 m2 g 。下列说法正确的是 。
a.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Cu2+
b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+
c.m1一定大于m2
d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中一定没有单质铜
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: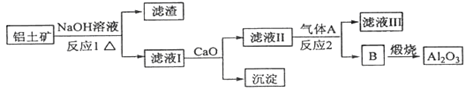
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: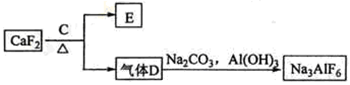
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。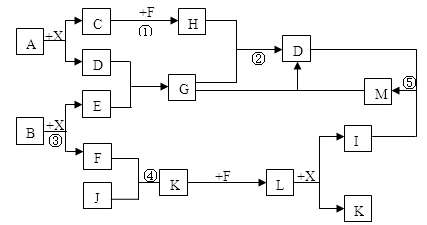
(1)写出化学式:A ,E ,L ;
(2)在反应①②③④⑤中属于氧化还原反应的是 ;
(3)反应③化学方程式为: ;
(4)写出下列离子方程式:反应② ;
G溶液与M溶液的反应 。
有机物A的分子式为C9H10O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):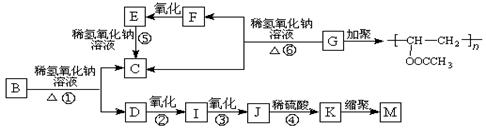
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
②-ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,该官能团的名称是 。
(2)上述变化中属于水解反应的是 (填反应编号)。
(3)写出结构简式,G: ,M: 。
(4)写出反应①的化学方程式: 。
(5)任写一种符合下列要求的A的同分异构体 。
I.含有苯环
II.能发生银镜反应,且能使氯化铁溶液显紫色
III.苯环上的一元取代物只有一种
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。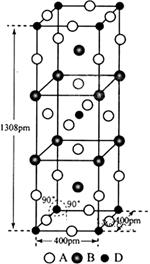
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________;该化合物中存在一个复杂离子,该离子的化学式为_______________,配位体是____________。