MnO2是具有多种特殊功能的材料,工业上用菱铁矿(MnCO3)为原料制备MnO2的工业流程如下: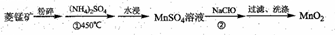
试回答以下问题:
(1)提高水浸效率的方法有______、______(填两种)。实验室里洗涤MnO2时用到的玻璃仪器有_____。NaClO的电子式为_________。
(2)反应①的化学方程式为___________。
(3)反应②生成MnO2的同时,得到一种黄绿色的气体,则该反应的离子方程式为__________。
(4)反应②的尾气常温下通入NaOH溶液后,生成NaClO可循环利用,若制得87gMnO2,理论上还需要补充NaClO______mol。
(5)工业上还可以将菱锰矿用硫酸直接浸取后,通过电解MnSO4和H2SO4的混合液制备MnO2,则电解时阳极的电极反应式为__________。
有机物对香豆酸(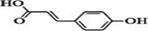 )主要用于配置香辛樱桃、杏、蜂蜜等香料。
)主要用于配置香辛樱桃、杏、蜂蜜等香料。
(1)写出对香豆酸的分子式 。
(2)下列关于对香豆酸的说法不正确的是 。
a.能与NaOH溶液反应
b.能发生加成、取代、银镜反应
c.加金属钠,有氢气生成
d.加FeCl3溶液,溶液发生显色反应
(3)对香豆酸的某种同分异构体丁,可用于除草剂苯嗪草酮的中间体,其可通过下图转化关系制得。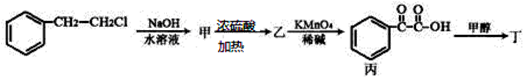
①乙→丙的反应类型 ;
②乙分子所含官能团是 (填名称);
③丙→丁的反应化学方程式: ;
(4)有机物戊与丁互为同分异构体,且满足以下特点:
①是苯的对位取代物,
②能与NaHCO3反应放出气体,
③能发生银镜反应。
请写出化合物戊的结构简式 (任写一个即可)。
利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳
光照转化成为四环烷(Q)的反应为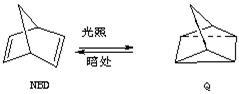
△H=+88.62 kJ/mol
(1)以下叙述错误的是 (填序号)
a.NBD的能量比Q的能量高 b.NBD和Q互为同分异构体
c.NBD的分子式为C7H8d.NBD能使溴水褪色
(2)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为 。若用氘(D)原子取代NBD分子中的一个H原子,可得到的同分异构体共有_________种。
(3)NBD分子可聚合生成高分子化合物,试写出反应的化学方程式 。
已知A、B、C、D、E、F、G七种元素原子序数均小于36,它们的核电荷数依次增大。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的基态电子排布中L能层有两个未成对电子,E和D同主族;F原子的基态电子排布中有4个未成对电子;G与F在周期表中同族,且G原子的外围电子排布中有2个未成对电子。根据以上信息填空:
(1) B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)
(2)F2+离子的价层电子排布图是 ,
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,E元素的氢化物的VSEPR模型为 。
(4)A和C形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物_____(填化学式);其中心原子C的杂化方式为 。
(5)化合物BD2、C2D和阴离子EBC-互为等电子体,它们结构相似,EBC-的电子式为 。F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为_______;
(6)GD的晶体结构与氯化钠相同,在晶胞中G离子的配位数是_______;已知晶胞的边长为a nm,晶体的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则晶体的密度为_________g·cm-3。
发展低成本、新型太阳能是解决未来社会能源问题的有效途径。目前,太阳能电池的发展已经进入了第三代,其常用材料除单晶硅,还有铜铟镓硒等化物质。完成下列填空:
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式_________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能从大到小顺序(用元素符号表示) 。
(3)硼元素与镓元素处于同一主族,三氟化硼分子的空间构型是___________;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B—X键都当作单键考虑来计算键长,理论值与实测键长结果如下表。硼卤键长实测值比计算值要短得多,可能的原因是______________。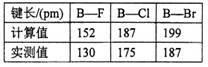
(4)金属铜能形成多种配合物,如复合物氯化羰基亚铜[Cu2C12(CO)2·2H2O],其结构如图。
①该配合物中Cl原子的杂化类型为____________。
②该配合物中的配位体有_____________种。
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为 ;
(6)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子,则得如图所示的金刚砂(SiC)结构。在SiC中,每个C原子周围最近的C原子数目为_____;若SiC晶体密度为a g.cm-3,SiC的摩尔质量为M g.mol-1,阿伏伽德罗常数用NA表示,则Si与C最近的距离为 pm (列式表示)。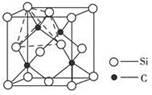
( 9分)氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸: Cl2 + H2O HCl + HClO K=4.5×10-4.次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。
HCl + HClO K=4.5×10-4.次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。
请回答:
(1)氯碱工业生产氯气的化学方程式为______________。
(2)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为________________。
(3)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 _________________ 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 __________(填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
②能说明Cl2的氧化性强于I2的实验现象是_______________。
③Cl2中含有少量HCl气体,可用_________试剂除去HCl,请用平衡移动的原理解释原因:__________。