已知A、B、C、D、E、F、G七种元素原子序数均小于36,它们的核电荷数依次增大。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的基态电子排布中L能层有两个未成对电子,E和D同主族;F原子的基态电子排布中有4个未成对电子;G与F在周期表中同族,且G原子的外围电子排布中有2个未成对电子。根据以上信息填空:
(1) B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)
(2)F2+离子的价层电子排布图是 ,
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,E元素的氢化物的VSEPR模型为 。
(4)A和C形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物_____(填化学式);其中心原子C的杂化方式为 。
(5)化合物BD2、C2D和阴离子EBC-互为等电子体,它们结构相似,EBC-的电子式为 。F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为_______;
(6)GD的晶体结构与氯化钠相同,在晶胞中G离子的配位数是_______;已知晶胞的边长为a nm,晶体的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则晶体的密度为_________g·cm-3。
甲、乙两同学在实验室分别取用不同试剂来制取Al(OH)3【可选试剂有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水】。
(1)请完成下表:
| 甲同学 |
乙同学 |
|
| 选用试剂 |
A1C13溶液、NaOH溶液 |
A12(SO4)3溶液、氨水 |
| 操作 |
向AlCl3溶液中逐滴加入NaOH溶液至过量 |
向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 |
||
| 化学方程式 |
A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
|
| 离子方程式 |
(2)若是你来制取Al(OH)3,试剂组合还可以是。
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明)。
根据下列转化关系以及现象回答: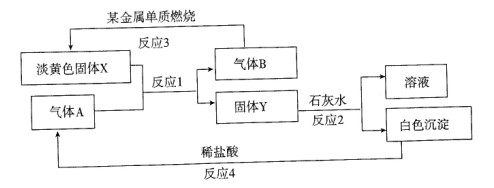
(1)固体X的名称是,Y的化学式是。
(2)写出反应l的化学方程式。
(3)写出反应2的化学方程式。
(4)若15.6g X和足量水反应,转移mol e-。
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O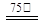 ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O 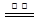 ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
(1)上述制备原理中属于氧化还原反应的是(选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ、(NH4)2Fe(SO4)2·6H2O,Ⅱ、ZnSO4·7H2O及Ⅲ、(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n(Zn2+)=。
②选用的加料方式是(填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,然后升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤干净的依据是_________________。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有:和。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4溶液。实验中可选用的试剂如下: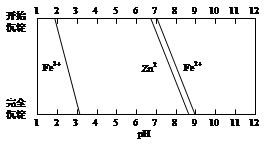
a.30%H2O2;
b.新制氯水;
c.1.0 mol·L-1NaOH溶液;
d.3 mol·L-1稀硫酸;
e.纯ZnO粉末;
f.纯锌粉。
实验步骤依次为:①将锌片完全溶于稍过量的3 mol·L-1稀硫酸,加入(选填字母,下同);②加入;③加热到60℃左右并不断搅拌;④过滤得ZnSO4溶液。其中步骤③加热的主要目的有。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为。若要计算该溶液的质量分数,还需要的一个条件是(用文字说明)。
(2)发生器中鼓入空气的作用可能是(选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的离子反应方程式为。
吸收塔的温度不能超过20℃,其目的是。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是(选填序号)。
a.Na2O2b.Na2Sc.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是(选填序号)
a.蒸馏b.蒸发c.灼烧d.过滤e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是(填操作名称)
铁及其化合物之间的相互转化可用下式表示: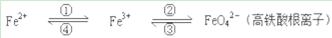
回答下列有关问题:
(1)铁元素在周期表中的位置是___________________________。
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
A.Cl2 B.Fe C.HNO3D.H2O2
(3)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价),下列说法正确的是________(选填序号)。
A.从物质分类的角度看,黄铜矿属于合金
B.反应中,所有铁元素均被还原
C.反应中,CuFeS2既作氧化剂又作还原剂
D.当转移1 mol电子时,46 g CuFeS2参加反应
(4)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 +K2O2 →K2FeO4 +K2O +K2SO4 +O2↑
(5)向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如右图所示。则混合溶液中HNO3和Fe(NO3)3的物质的量浓度之比为__________。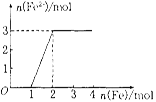
(6)某同学将铁与水蒸气高温反应后的固体物质溶解在过量盐酸中,如何判断所得溶液中是否含有Fe3+? ___________________________________________________________。