(6分,每空1分)已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A是最外层为一个电子的非金属元素,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C=4:2:3。
请回答下列问题:
(1)写出B的原子结构示意图 ,写出C和D形成的淡黄色固体化合物的电子式 。
(2)元素原子的物质的量之比为A:B:C="4:2:3" 的晶体名称为 。
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例) 、 。
(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式 。
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
请回答下列问题:
(1)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是,理由是:
。
(2)从滤液E中得到绿矾晶体的实验操作是。
(3)请用一个总反应式表示由滤渣F制备胆矾晶体过程中发生的变化:
。
(4)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理,理由是
。
已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题。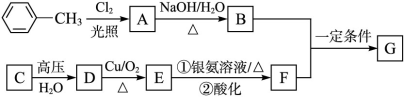
(1)G的结构简式为__________。
(2)指出下列反应的反应类型:A转化为B:______,C转化为D:__________。
(3)写出下列反应的化学方程式:
D生成E的化学方程式:________________________。
B与F生成G的化学方程式:____________________。
(4)符合下列条件的G的同分异构体数目有____种:①苯环上有3个取代基,且有两个取代基相同;②能够与新制的银氨溶液反应产生光亮的银镜。其中氢原子共有四种不同环境的所有物质的结构简式为__________、____________。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备 CuSO4·5H2O及纳米材料G,步骤如下: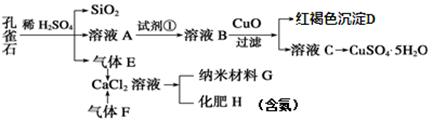
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为_____(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
向溶液B中加入CuO的作用是。
(2)由溶液C获得CuSO4·5H2O,需要经过 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)写出制备G的化学反应方程式。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(4)欲测定溶液A中Fe2+的溶液,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为。
二甲醚(CH3OCH3,沸点为-24.9℃)被称为21世纪的新型能源。科学家利用太阳能分解水生成的氢气与从烟道气中分离出的CO2在催化剂作用下合成二甲醚,并开发出直接以二甲醚为燃料的燃料电池。其合成流程如下: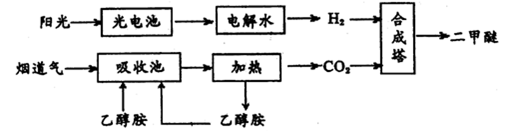
(1)已知:CH3OCH3(g)、H2(g)的标准燃烧热分别为:△H= -1455.0kJ·mol-1、△H=" -285.8" kJ·mol-1。写出以CO2、H2合成CH3OCH3的热化学方程式:;
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。写出吸收CO2反应的化学方程式;
(3)一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图1所示,当控制气流量为28mL· min-1时,则生成0.3mol二甲醚需要通入CO2的物质的量为;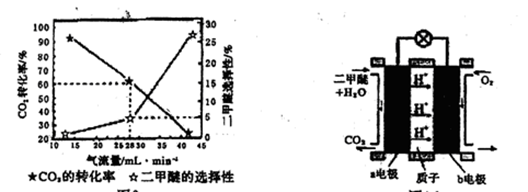
图1图2
(4)图2为二甲醚燃料电池示意图。
①a电极的电极反应式为;
②若以1.12 L·min-l(标准状况)的速率向该电池中通入二甲醚,用该电池电解50mL2 mol·L-1 CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为。
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下: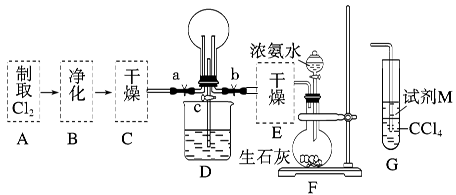
请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。A中反应物是KMnO4和浓盐酸,请写出A中发生反应的化学方程式:,请写出试剂M为溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为_________________________________________________________________。
(2)某废水中含有一定量的Na+、SO ,可能含有CO
,可能含有CO ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO 的浓度,设计如下实验方案:
的浓度,设计如下实验方案:
①从下列试剂中选择试剂X为_________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO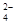 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;
③证明该废水中是否含有CO 的实验方案为。
的实验方案为。