下表是某橙汁饮料包装袋上的说明:
| 品名 |
浓缩橙汁 |
| 配料 |
水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、山梨酸钾等 |
| 鲜橙原汁含量 |
≥20% |
| 净含量 |
1.5L |
| 生产日期 |
标于瓶盖上 |
(1)配料中属于着色剂的是
(2)该橙汁饮料 (填“含有”或“不含”)防腐剂。
(3)上述各种配料中,国家对 、 的含量进行严格规定加以控制。
亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:
已知:
①纯ClO2易分解爆炸,空气中ClO2 的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A 可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸c. KMnO4
(2) 反应Ⅱ的离子方程式为_________。
(3) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是____________。
(5) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2和CO2。若处理含NaCN4×10-5mol ·L-1的废水 1000L,至少需要ClO2的质量为___________g。
五氯化磷(PCl5)是有机合成中重要的氯化剂,可以有三氯化磷(PCl3)氯化得到: 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如下表所示:
。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如下表所示:
(1) 0~150s内的平均反应速率
(2) 该温度下,此反应的化学平衡常数的数值为___________(可用分数表示)。
(3) 反应至250s 时,该反应放出的热量为______________kJ。
(4) 下列关于上述反应的说法中,正确的是__________(填字母序号)。
a. 无论是否达平衡状态,混合气体的密度始终不变
b. 300s 时,升高温度,正、逆反应速率同时增大
c. 350s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d. 相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,达到化学平衡状态时,n(PCl5 ) < 0.20mol
(5) 温度T 1时,混合气体中PCl5 的体积分数随时间t 变化的示意图如下。其他条件相同,请在下图中画出温度为T 2(T 2> T 1)时,PCl5的体积分数随时间变化的曲线。
A、B、D、E、G 是原子序数依次增大的五种短周期元素。A 与E 同主族,A、B 和E的原子最外层电子数之和为19,B 与G 的单质都能与H2 反应生成“HX”(X 代表B 或G)型氢化物,D 为同周期主族元素中原子半径最大的元素。
(1) B 在元素周期表中的位置是_____________。
(2) D 的两种常见氧化物中均含有____________(填“离子键”或“共价键”)
(3) E 的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为_______。
(4) D 的最高价氧化物对应水化物的溶液与G 的单质反应,反应的离子方程式为_______。
(5) 共价键的极性随共用电子对偏移程度的增大而增强,A 和E 所形成氢化物中,共价键极性的强弱顺序为____________>___________(用化学式表示)。
(6) 用原子结构解释“B、G 单质都能与H2 反应生成HX 型氢化物”的原因:_________。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: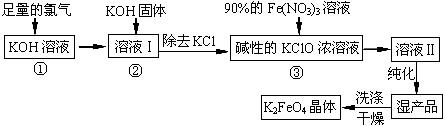
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:
FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
完成以下化学方程式
(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2) KMnO4 + HBr= Br2 + MnBr2 + KBr + H2O