亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:

已知:
①纯ClO2易分解爆炸,空气中ClO2 的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A 可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2) 反应Ⅱ的离子方程式为_________。
(3) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是____________。
(5) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2和CO2。若处理含NaCN4×10-5mol ·L-1的废水 1000L,至少需要ClO2的质量为___________g。
有机物F(C13H16O2)是一种芳香酯,可用作香精的调香剂。如下图是该有机物的合成路线: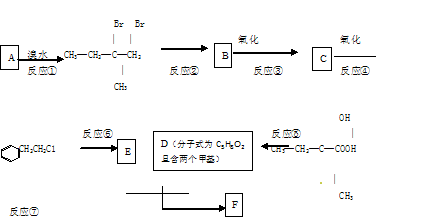
请回答下列问题:
(1)反应②中另 加的试剂是;反应⑤的一般条件是:。
加的试剂是;反应⑤的一般条件是:。
(2)反应③的化学方程式为。
(3)反应⑦的化学方程为。
(4)上述合成路线中属于取代反应的是 (填编号)。
(5)C的同分异构体有多种,其中能发生水解反应的有机物有 种。
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含 有同种元素。
有同种元素。
已知 :(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是(填序号)。
(2)G生成B有多种途径。若在G的溶液中加入与G等物质的量的Na2O2,恰好使G转化为B,写出该反应的离子方程式:。
反应③(即D将某种氧化物氧化为F)的离子方程式。
(3)D的水溶液显酸性,请用离子方程式解释原因。
(4)实验室制取C的化学方程式为 。
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.61 2×1023个。请按照要求填空:
2×1023个。请按照要求填空:
| 实验步骤 |
实验现象 |
用化学用语解释 |
| 将少量气体通入淀粉KI溶液 |
溶液最初变成色 |
(用离子方程式表示) |
| 继续通入气体 |
溶液逐渐变成无色 |
(用化学方程式表示) |
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B____,D。
(2)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该
化合物化学式为____。
(3)C常用作净水剂,用离子方程式表示其净水原理________。
(4 )在A溶液中加入少量澄清石灰水,其离子方程式为____。
)在A溶液中加入少量澄清石灰水,其离子方程式为____。
(5)向20mL 2mol/L C溶液中加入30mL E溶液,充分反应后得到0 .78g沉淀,
.78g沉淀,
则E溶液的物质的量浓度可能是moI·L-1
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:①Cl2→Cl+Cl②Cl+H2→HCl+H③H+Cl2→HCl+Cl……反应②中形成的化合物的 电子式为 ;反应③中被破坏的化学键属
电子式为 ;反应③中被破坏的化学键属 于键(填“极性”或“非极性”)。
于键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是(用元素符号表示)。与氯元素同周期且金属性最强的元素 位于周期表的第
位于周期表的第 周期族。
周期族。
( 3)卤素单质及化
3)卤素单质及化 合物在许多性质上都存在着递变规律。下列有关说法正确的是。
合物在许多性质上都存在着递变规律。下列有关说法正确的是。
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H—F、H—C1、H—Br、H—I的顺序依次减小
c.卤化 氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
则镁铝合金中加NaOH溶液的化学反应方程式为▲,
金属X是▲,固体A的化学式▲,操作②包含的步骤有蒸发浓缩、▲、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称▲,需要测定的数据有▲。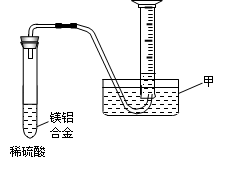
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+
的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为▲mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。