海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl ……反应②中形成的化合物的 电子式为 ;反应③中被破坏的化学键属
电子式为 ;反应③中被破坏的化学键属 于 键(填“极性”或“非极性”)。
于 键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示)。与氯元素同周期且金属性最强的元素 位于周期表的第
位于周期表的第  周期 族。
周期 族。
( 3)卤素单质及化
3)卤素单质及化 合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H—F、H—C1、H—Br、H—I的顺序依次减小
c.卤化 氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(2分) 相对分子质量为M的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度为ρg·cm-3,则该饱和溶液的物质的量浓度是
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):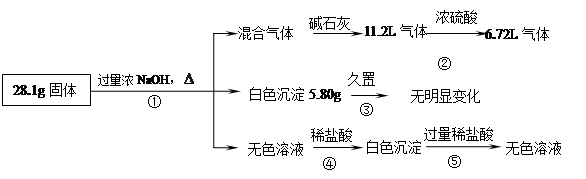
回答下列问题:
(1)混合物中是否存在FeCl2(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4(填“是”或“否”),你的判断依据是。
(3)写出反应④的离子反应式:。
(4)请根据计算结果判断混合物中是否含有AlCl3(要求写计算过程)
下图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。试回答下列问题: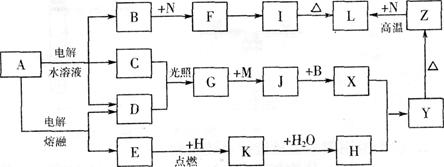
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用隔开。(填设备名称)
(2) 写出A的水溶液电解的离子方程式。
(3) 写出K与CO2反应的化学方程式。
(4) Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,写出该反应的离子方程式。
(5) 一定量的Z与N的混合物分为两等分,一份直接与足量氢氧化钠溶液产生气体为amol,另一份高温下充分反应(不考虑固体与氧气的反应)后的固体混合物与足量盐酸产生气体为bmol,现有a:b=9:7,则混合物中Z与N的物质的量之比为。
等质量的铜、锌、铁的金属混合物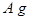 加入FeCl3和盐酸的混合液中,充分反应(不考虑水电离出的离子)。
加入FeCl3和盐酸的混合液中,充分反应(不考虑水电离出的离子)。
(1)若无固体剩余,则溶液中的阳离子一定有,可能有;
(2)若剩余固体为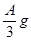 ,则溶液中的阳离子一定有,一定没有;
,则溶液中的阳离子一定有,一定没有;
(3)若剩余固体为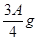 ,则溶液中的阳离子一定有_________,一定没有___________。
,则溶液中的阳离子一定有_________,一定没有___________。
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系: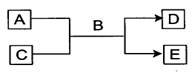
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则该反应的化学方程式为:______,检验D中阴离子所用试剂为:。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行。写出A与强碱溶液反应的离子方程式:
(3)若A、C均为化合物,C为引起温室效应的主要气体且过量,E为白色胶状沉淀,写出E可能的物质的化学式:或。写出其中一个生成E的离子方程式:。