(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
则镁铝合金中加NaOH溶液的化学反应方程式为 ▲ ,
金属X是 ▲ ,固体A的化学式 ▲ ,操作②包含的步骤有蒸发浓缩、 ▲ 、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称 ▲ ,需要测定的数据有 ▲ 。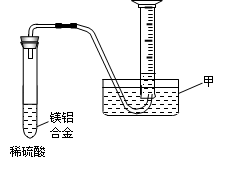
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+
的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为 ▲ mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。 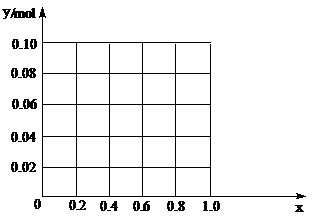
下图转化关系中涉及的均是中学化学常见物质(部分产物中的水已略去)。其中A、B、C、D、E、F、G、H在常温下均为气体,且D为红棕色,G为黄绿色。I、J均为白色固体。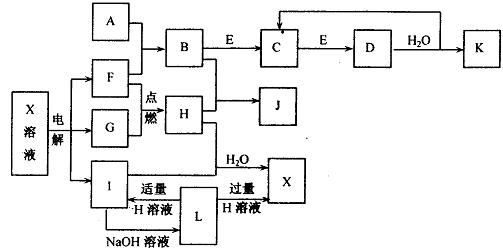
请按要求回答下列问题:
(1)D的化学式为;A的电子式为;
G中所含元素在周期表中的位置是。
(2)写出电解X溶液的阳极反应式。
(3)J溶液的pH(填“<”、“>”或“=”)7;
X溶液pH<7的原因是(用离子方程式表示):
(4)若使1mol B尽可能多地转化为K,则消耗E的物质的量最多为
X、Y、Z、W和R都是周期表中前20号元素,且原子序数依次递增。已知:
①W的阳离子和Z的阴离子具有相同的核外电子排布,且能形成组成为WZ的化合物;
②X原子的最外层只有一个电子,X元素可以和Z元素组成原子个数比为2:1和1:1的两种化合物;
③R和W属同一主族元素。
④Y和Z 属于同一周期元素,它们能形成两种气态化合物;
请回答:
(1)W元素是;Z元素是。
(2)化合物WZ的化学式是。
(3)Y和Z形成的两种常见化合物的分子式中,两原子均满足8e-结构的化合物的结构式为。
(4)写出在实验室中利用五种元素中的两种形成的化合物制备Z单质的化学反应化学方程式:。
科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部位于元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a~g 7种短周期元素,是除氧、硫、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
(1)元素的原子间反应最容易形成离子键的是下列中的(),元素的原子间反应容易形成共价键的是下列中的()
A.c和f B.b和g C.d和g D.d和e
(2)下列由a~g形成的各分子中,所有原子都满足最外层为8电子结构的是()。
A.ea3 B.ag C.fg3 D.dg4
(3)由11种元素的几种非金属元素构成的离子化合物的电子式为______。
(4)c与e可形成一种化合物,试根据原子结构写出该化合物的化学式 ,
化学键类型为 ,与稀盐酸反应的方程式为.
已知下列热化学方程式:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g)ΔH=-131.3 kJ/mol
③H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l)ΔH=-57.3 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
⑤CO(g)+O2(g)===CO2(g) ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l) ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有______________,不正确的理由分别是________
(2)根据上述信息,写出C转化为CO的热化学方程式:。
(3)上述反应中,表示燃烧热的热化学方程式有;
表示中和热的热化学方程式有______________。
(1)写出电子式: KCl; CO2
(2)用电子式表示下列化合物的形成过程: CaF2: NH3: