硼.碳.氮.硅元素的单质及其化合物是构成自然界的重要物质。
(1)硼元素原子核外电子排布式_________________。氮元素原子的核外电子中,未成对电子数与成对电子数之比为 。
(2)甲烷是最简单的有机物,实验室可通讨下列反应制取: ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
(3)甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2 H2O → 8Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断非金属性Si比 H (填“强”.“弱”或“无法比较”)
(4)石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
氧化铜矿中含有主要杂质为Fe2+和Al3+等,用其生产CuSO4·5H2O主要工艺流程如下图。
(1)图中加入氧化剂的目的是,结合下表回答除铁步骤的最佳pH范围为。
(2)氧化剂若选用KMnO4,会降低产品的纯度,其原因是,实际生产中NaClO作为最佳氧化剂,发生反应的离子方程式为。
(3)请在下图中完善所缺步骤及所添加试剂的化学式。可供选择的操作有:萃取、蒸发浓缩、过滤、洗涤、降温结晶、蒸馏、分液。
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
表2
请回答下面问题:
(1)CH3COONH4的水溶液呈(选填“酸性”、“中性”或“碱性”),理由是。溶液中各离子浓度大小关系是。
(2)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为。
(1)已知在常温下测得浓度均为0.1 mol/L的下列5种溶液的pH:
根据上述信息判断,浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是(填编号);其pH为(填数值);pH最大的是(填编号)。
①CH3COOH②HCN③HClO ④H2SO4⑤HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液。
②在侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的一个规律:;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是,
请写出反应的离子方程式:。
为了证明醋酸是弱电解质,甲、乙、丙、丁、戊、己、庚七人分别选用下列试剂进行实验:
0.10 mol/L醋酸溶液、0.10 mol/L醋酸钠溶液、pH=3的盐酸、pH=3的醋酸、醋酸钠晶体、氯化钠晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?。(填“正确”或“不正确”)
(2)乙取出10 mL 0.10 mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1 000 mL,再用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是(用等式或不等式表示)。
(3)丙取出10 mL 0.10 mol/L醋酸溶液,滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,你认为这一方法能否证明醋酸是弱电解质?。(填“能”或“不能”)
(4)丁用pH试纸来测定0.10 mol/L醋酸钠溶液的pH,发现0.10 mol/L醋酸钠溶液的pH为9,则认定醋酸是弱电解质,你认为这一方法正确吗?。(填“正确”或“不正确”)
茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: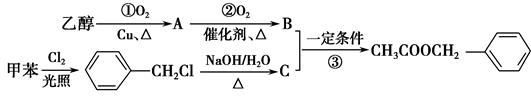
(1)写出反应①的化学方程式:______________________________________。
(2)反应③的反应类型为______________。
(3)写出C中的官能团的名称:_______________________________________。
(4)上述①②③三个反应中,原子的理论利用率为100%,符合绿色化学要求的反应是________(填序号)。
(5)乙酸苯甲酯有很多同分异构体,含有酯基和一取代苯结构的同分异构体有五种,其中三种的结构简式是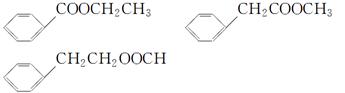
请写出另外两种同分异构体的结构简式:_____________和_____________。