氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应可能产生H2 |
| C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O |
| D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
| A.标准状况下,1L庚烷所含有的分子数为NA/22.4 |
| B.1mol甲基(—CH3)所含电子数为9NA |
| C.标准状况下C2H4体积22.4L,所含的电子数为16NA |
| D.26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
下列分离或除杂方法不正确的是
| A.用蒸馏法分离水和酒精 |
| B.用萃取法分离苯和溴苯 |
| C.用重结晶法除去硝酸钾中的氯化钠杂质 |
| D.用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
下列物质中既属于芳香化合物又属于醇的是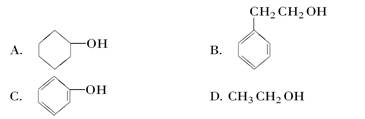
下列化学用语书写正确的是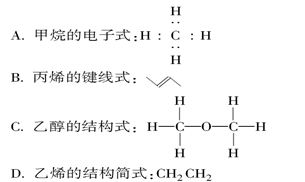
有A、B两种烃,含碳元素的质量分数相等,下列关于A和B的叙述正确的是
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B实验式一定相同
D.A和B各1 mol完全燃烧后生成的CO2的质量一定相等