(1)二氧化硅与碳高温下反应的化学方程式为
上述反应中生成的单质有什么用途: (写一条即可)。卞石是硅酸盐,不同类型的卞石中氧原子的物质的量分数相同,由钠卞石化学式NaAlSi3O8可推知钙卞石的化学式为 ,请将钠卞石的化学式改写成氧化物的形式:
(2)天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
COS Na2S溶液
Na2S溶液 H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
(1)已知25℃时,1 g H2在氧气中完全燃烧生成液态水,放出热量142.9kJ。写出该反应的热化学方程式:__________________。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,在电极上分别吹入氢气和氧气。写出负极的电极反应式:_________________________。
该电池工作一段时间后正极区附近溶液的pH值将______(填:变大、变小或不变)。
(3)在相同条件下,1 mol H2直接燃烧产生的能量与设计成燃料电池产生的能量______(填:直接燃烧多、燃料电池多、一样多)。
(4)氢气是一种十分理想的清洁能源,目前还面临着储运中因沸点太低难以液化的问题,请简述氢气沸点很低的原因_____________________。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: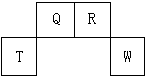
(1)W在周期表中的位置是_________________, Q、R、T三种元素原子的半径从大到小排列顺序__________ (用元素符号表示),Q的最高价氧化物的电子式_____________,R气态氢化物分子的结构式为_____________。
(2)元素的原子得电子能力:Q______W(填“强于”或“弱于”)。
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点(填“高”或“低”)于R的的常见气态氢化物。
(4)T、Q、R、W的单质中,固态时属于原子晶体的是_____________(填名称)。
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在上表中的对应编号__________,与T同周期且最高价氧化物的水化物碱性最强的元素在上表中的对应编号____________,编号为⑥的最高价氧化物的水化物的电子式。
(1)在下列变化中① I2升华,②烧碱熔化,③二氧化硅熔化,④NaCl溶于水,⑤HCl溶于水,⑥晶体Ar熔化,⑦Na2O2溶于水,⑧NaHSO4溶于水。未破坏化学键的是;仅离子键被破坏的是;仅共价键被破坏的是;离子键和共价键同时被破坏的是。
(2)试判断:①SiO2,②CO2,③CS2,④KCl晶体的熔点由高到低排列的顺序:
(填相应物质的编号)。
下列物质:① 与
与 ;②O2与O3;③正丁烷和异丁烷;④金刚石和石墨;⑤冰与水;⑥CH3CH2OH和CH3OCH3;⑦H2与D2。
;②O2与O3;③正丁烷和异丁烷;④金刚石和石墨;⑤冰与水;⑥CH3CH2OH和CH3OCH3;⑦H2与D2。
(1)互为同素异形体的是
(2)互为同分异构体的是
(3)互为同位素的是
食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是。
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5g/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的(填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。
①滴定醋酸溶液的曲线是(填“图l”或“图2”);滴定曲线中a=mL;
②E点pH>8的原因用离子方程式表示。
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是。
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸