短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: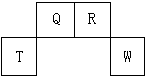
(1)W在周期表中的位置是_________________, Q、R、T三种元素原子的半径从大到小排列顺序__________ (用元素符号表示),Q的最高价氧化物的电子式_____________,R气态氢化物分子的结构式为_____________。
(2)元素的原子得电子能力:Q______W(填“强于”或“弱于”)。
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点 (填“高”或“低”)于R的的常见气态氢化物。
(4)T、Q、R、W的单质中,固态时属于原子晶体的是_____________(填名称)。
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在上表中的对应编号__________,与T同周期且最高价氧化物的水化物碱性最强的元素在上表中的对应编号____________,编号为⑥的最高价氧化物的水化物的电子式 。
石墨的片层结构如图所示,试完成下列各题:
(1)平均 个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是 。
某有机物的结构式如下: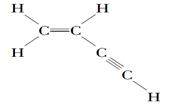
则分子中有________个σ键,________个π键。
(1)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(2)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________。CO2与CS2相比,________的熔点较高。
已知N、P同属于元素周期表的第VA族元素,N在第2周期,P在第3周期。NH3
分子呈三角锥形,氮原子位于锥顶,三个氢原子位于锥底,N—H键间的夹角是107°。
(1)PH3分子与NH3分子的构型关系是________(填“相同”或“相似”或“不相似”),P—H______极
性(填“有”或“无”),PH3分子________极性(填“有”或“无”)。
(2)NH3与PH3相比,热稳定性________(填化学式)更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________.
| A.键的极性N—H比P—H强 | B.分子的极性NH3比PH3强 |
| C.相对分子质量PH3比NH3大 | D.NH3分子之间存在特殊的分子间作用力 |
单质硼有无定形和晶体两种,参考下表数据
晶体硼的晶体类型属于晶体,理由是