氯气及氯的化合物有着广泛的应用
(1)已知可逆反应Cl2+H2O HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
(2)我国卫生部已明确提出:逐步用二氧化氯替代氯气进行饮用水的消毒。
①用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。卫生部规定,饮用水中ClO 2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
②用ClO2处理过的自来水中会残留ClO2 ,可用FeCl2将ClO2还原为Cl-,该反应的氧化产物是 (填化学式)。现用V L(已换算为标准状况)ClO2处理一定量自来水,再加入a mol FeCl2可将残留的ClO2恰好除去。则该自来水中残留ClO2的物质的量为 mol。
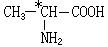 有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如
有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如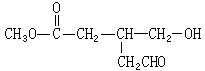 ①标出下列有机物X中的手性碳原子:
①标出下列有机物X中的手性碳原子:
②若使有机物X通过化学变化,使生成物中不再具有手性碳原子从而失去光学活性,可能发生的反应类型有___________________。(只限一步转化)
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:
 |
(1)写出A的电子式;C的结构简式;
(2)写出苯和液溴反应生成E的化学方程式;
其反应类型为。
已知某有机物的相对分子质量为58。根据下列条件回答:
若该有机物的组成只有C、H,则此有机物的分子式为;若它的核磁共振氢谱只有2个峰,则它的结构简式为。
乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃
后充分反应,乙烯和乙烷全部消耗完,得到CO到CO2的混合气体和45g水。试求:
⑴ 当a =1时,乙烯和乙烷的物质的量之比n (C2H4)∶n (C2H6)= 。
⑵ 当a =1,且反应后CO和CO2混合气体的物质的量为反应前氧气的3/2时,则
b= ,得到的CO和CO2的物质的量之比n (CO)∶n (CO2)= 。
⑶a的取值范围是 。
⑷b的取值范围是 。
某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,通过计算回答:
(1)混合气体中气态烷烃的化学式: ,
(2)混合气体中两种气体的物质的量之比: ,
(3)写出混合气体中气态烯烃可能的结构简式: 。