(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”“中”“碱”),溶液中c(Na+) c(CH3COO-)(填 > < =);
(2)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,m与n的大小关系是m n (填 > < = )。
(14分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水.A和E可形成离子化合物,其晶胞结构如下图所示: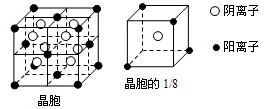
(1)A、C、D、E四种元素依次是____ ____ ____ ____ (用元素符号表示)。
(2)上述四种元素ABCD中第一电离能最小的是________电负性最大的是________其原子半径由小到大的顺序为________________(均用元素符号表示)。
(3)A和D的氢化物中,前者沸点较高,原因是________________________________。
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有个________。
(12分)下列物质:①H2②HF ③H2O2 ④KF ⑤NH4Cl ⑥C2H2⑦N2H4+⑧BF3⑨H2O ⑩N2(填序号)
(1)只含非极性键的是___________________
(2)只含极性键的极性分子是_____________
(3)既有极性键又有非极性键的是_________
(4)只有σ键的是_______________________
(5)既有σ键又有π键的是_______________
(6)含有配位键的是_____________________
(14分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_________________________,该化合物由________键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是
________________________________,________________________________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________ (填“>”“=”“<”) r(N3-)。
(14分)分析下图,回答以下问题: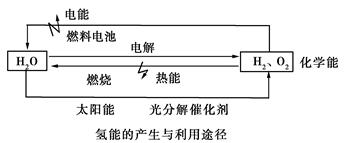
(1)水电解生成H2,首先要解决的问题是________________________________。
(2)氢气作为理想的“绿色能源”除了来源丰富,还有哪些优点:
①________________________________,②_____________________________。
(3)氢氧燃料电池是氢能源利用的一个重要方向,氢气在________极上发生________反应。若电解质溶液为KOH溶液,写出正负极上的电极反应:
正极________________________________,负极________________________________。
(10分)X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为________。
(2)Z2X属于________(共价或离子)化合物。
(3)Z2Y2中含有________键和________键,Z2Y2溶于水时发生反应的化学方程式是_______________。