(14分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_________________________,该化合物由________键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是
________________________________,________________________________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________ (填“>”“=”“<”) r(N3-)。
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体,F是由两种短周期元素构成的离子化合物,其转化关系如图 (反应条件和部分产物略去)。试回答: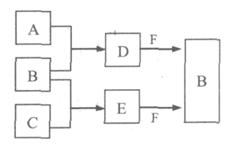
(1) F的电子式是。
(2)写出E与F反应生成B的化学方程式,并用双线桥标出电子转移的方向与数目
(3) 单质X和B或D均能反应生成黑色固体Y,Y与盐酸反应的离子方程式是。若固体恰好溶解,则所得溶液呈性。
(4) 物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是。
(5) 取0.3 mol F与足量D充分混合后,所得溶液中再通入0.4 mol E充分反应,最后得到产物的物质的量比为。(不考虑水解)
(6) E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是。
(已知甲醇的燃烧热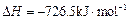 ,氢气的燃烧热
,氢气的燃烧热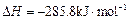 )
)
离子推断题
某待测液中可能含有Mg2+、NH4+、Ba2+、CO32-、SO42-、AlO2-等离子,各取少量进行如下实验:
(1)加足量NaOH溶液并加热,过程中无沉淀也无气体生成,可排除
离子大量存在;
(2)加入过量的稀盐酸,先出现白色沉淀,后来沉淀逐渐溶解消失。继续加稀硫酸,又出现白色沉淀。可肯定含有 离子,并排除
离子大量存在。
 某化学兴趣小组模拟工业上从铝土矿(主要成分是
某化学兴趣小组模拟工业上从铝土矿(主要成分是 ,含
,含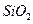 、
、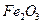 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: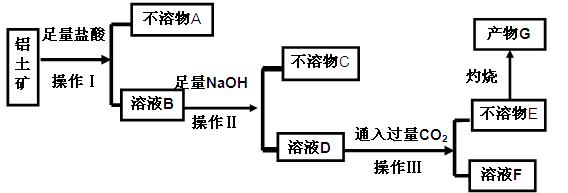

 请回答下列问题:
请回答下列问题: (1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。 (2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。
(2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。 (3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
(3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
按要求进行书写:
(1)氯化铝溶液与足量的氨水反应的离子方程式:
(2)用氯化铁溶液蚀刻印刷铜电路板反应的离子方程式:
(3)解释装氢氧化钠溶液的试剂瓶不能用磨口玻璃塞原因的化学方程式:
(4)等物质的量的二氧化硫与氯 气同时通入水中反应的化学方程式:
气同时通入水中反应的化学方程式:
9.5g MgCl2溶于水配成100mL溶液,所得溶液的物质的量浓度为 ,取溶液25.0mL,稀释到500mL,此时溶液中Cl-的物质的量浓度为 ,在这两个实验中除了用烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是 。