A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体,F是由两种短周期元素构成的离子化合物,其转化关系如图 (反应条件和部分产物略去)。试回答: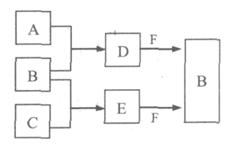
(1) F的电子式是 。
(2)写出E与F反应生成B的化学方程式,并用双线桥标出电子转移的方向与数目
(3) 单质X和B或D均能反应生成黑色固体Y,Y与盐酸反应的离子方程式是 。若固体恰好溶解,则所得溶液呈 性。
(4) 物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(5) 取0.3 mol F与足量D充分混合后,所得溶液中再通入0.4 mol E充分反应,最后得到产物的物质的量比为 。(不考虑水解)
(6) E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热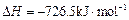 ,氢气的燃烧热
,氢气的燃烧热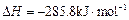 )
)
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
可能发生氧化还原反应,下列反应可能发生的是 。
A.NH4NO3 → N2 + O2 + H2O
B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O
D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O
F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
①H2O2处理法:NaCN + H2O2 —— N2↑+ X + H2O推测X的化学式为 。
② NaClO处理法:aCN-+bClO-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O
方程式中e : f的值为 (填选项标号)。
A.1B.1/2 C.2D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:______________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示: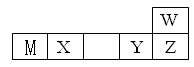
其中只有M为金属元素,请回答下列问题:
(1)M在元素周期表中的位置为 ,比较Y与Z两种元素的简单离子的半径大小 (用离子符号表示)。
(2)写出X的氧化物与W的氢化物的水溶液反应的化学方程式 。
(3)科学家研制出一种新型分子C16Y8(结构如图所示)
它将成为潜在的储氢材料。1molC16Y8最多能与 molH2发生加成反应。
(4)一种名贵黄石组成为M2(XO4)WOH,在强碱性溶液中会发生腐蚀,写出其过量NaOH溶液反应的化学方程式 。
Cl2及其化合物在生产、生活中具有广泛的用途。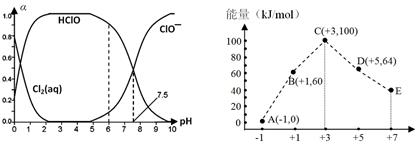
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是________________;
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为_________________________。
(2)①ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式________ ;
②工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,生成ClO3–的电极反应式为_________________ ___。
(3)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号);
②B → A + D反应的热化学方程式为 (用离子符号表示)。
(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值__ ___20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)=___________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:
①若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是 ;
为测定Na2CO3和NaHCO3混合物中的质量分数,下列方案可行的是
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
②所得溶液中含量最多的三种离子的物质的量浓度的大小关系为
【化学一一选修5:有机化学基础】
某药物可通过以下方法合成: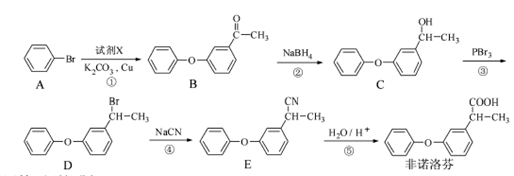
注:非诺洛芬是一种治疗类风湿性关节炎的药物。请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
(3)在上述五步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以 为原料制备
为原料制备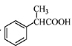 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: