 某化学兴趣小组模拟工业上从铝土矿(主要成分是
某化学兴趣小组模拟工业上从铝土矿(主要成分是 ,含
,含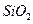 、
、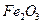 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: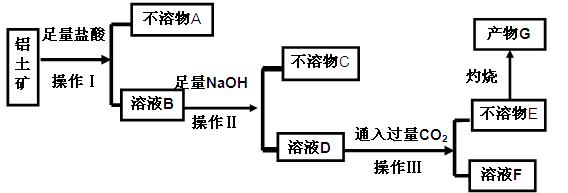

 请回答下列问题:
请回答下列问题: (1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。 (2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。
(2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。 (3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
(3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
(6分)氮其化合物是中学化学的基础知识,请你回答下列含氮化合物的有关问题。
(1)汽车尾气中含有氮氧化物,严重污染大气。NO和NO2是常见的氮氧化物,这两种氮氧化物中,呈红棕色的是 ;
(2)一氧化氮在常温下很容易与空气中的氧气化合,生成二氧化氮。该反应的化学方程式为: ;
(3)实验室常用NH3做“喷泉实验”,该实验说明NH3的溶解性是 溶于水(填“极易”或“极难”)。
能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢所是最理想的清洁能源之一。已知反应:2H2+O2 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为 反应(填“吸热”或“放热”);
(2)当生成18gH2O时,H2O的物质的量是 (填字母代号)。
A、1mol B、1mol/L C、1g/mol
现有:①铁锅②鸡蛋③白酒④乙烯。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中(填编号)。
(1)可以作为水果催熟剂的是 ;(2)含有乙醇的是 ;
(3)在潮湿的空气中会生锈的是 ;(4)富含蛋白质的是 。
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素。请回答: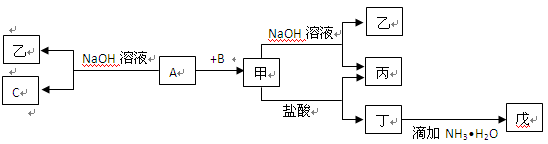
(1)写出下列物质的化学式:乙、丁、戊。
(2)写出甲物质在工业上的一种主要用途:。
(3)写出甲→乙+丙反应的离子方程式:;
A→乙+C反应的化学方程式:
下图是用自来水制取少量蒸馏水的简易装置,其原理与教材中的实验完全相同。回答下列问题:
(1)左边圆底烧瓶中要加入几片碎瓷片,其作用是;
(2)该装置中使用的玻璃导管较长,其作用是;
(3) 烧杯中还要盛有的物质是 ,其作用是:。