(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、 普通漏斗、玻璃棒、烧杯。
①若要进行中和滴定实验,还缺少的玻璃仪器是______________________.
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是________.
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A KI溶液 B 淀粉溶液 C NaOH溶液 D 稀H2SO4 E 氯水
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色。
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号) 。
(3)众所周知,氢气燃烧生成水。然而,资料表明,氢气燃烧时除生成水外,还生成另一产物。某同学用如右图所示的实验装置,验证该产物的存在。实验步骤及现象如下:制 H2、验纯,将火焰对着冰块。

①在小烧杯内加入用硫酸酸化的稀KI淀粉溶液,将小烧杯放在冰块下方,观察到烧杯中溶液由无色变成了蓝色。
②在另一个小烧杯内加入用硫酸酸化的稀 KMn04溶液,将小烧杯放在冰块下方,观察到烧杯中溶液变成了无色。请你写出另一产物的结构式: ;
由上述实验中可以归纳出该产物的化学性质有 。
Ⅰ、亚硫酸钠中的硫元素为+4价,请选择下面所提供的化学试剂,设计简单的实验,证明亚硫酸钠既有氧化性,又有还原性。(所提供的试剂为:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、NaOH溶液、氨水)
(1)要说明Na2SO3具有氧化性,应选用的试剂是,观察到的现象是。
(2)要说明Na2SO3具有还原性,应选用的试剂是,反应的离子方程式是_______________。
Ⅱ、某亚硫酸钠试剂已被部分氧化。为了确定它的纯度,要进行如下实验:
①称取样品 a g;
②将样品溶解;
③在溶液中加入稍过量的盐酸酸化的BaCl2溶液;
④将沉淀过滤,洗涤、干燥后称重,质量为b g。
试回答:
(1)BaCl2溶液要用盐酸酸化的原因是;
(2)BaCl2溶液要稍过量的原因是;
(3)判断沉淀是否洗尽的方法是;
(4)Na2SO3样品纯度的计算式是。
III、现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。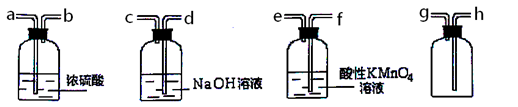
①要达到实验目的,按气流从左到右,各接口连接顺序正确的是_______。
A.dcabhB.feabhC.feabg
②本实验除去SO2的原理是利用SO2的________性质。
[9分] (1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
30 |
120 |
280 |
350 |
370 |
①反应速率最大的时间段(即0~1、l~2、2~3、3~4、4~5 min)为_____________,原因是__________________________________________________
②反应速率最小的时间段为_________,原因是________________________ ___
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是__________________(填相应字母);
做法中不可行的理由是___________________________________________________。
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省)如下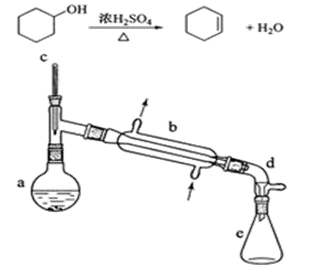
相关数据如下: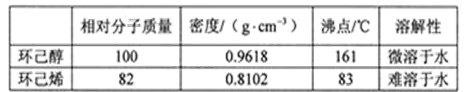
实验步骤:
1、[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸。b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃。
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2。再进行蒸馏最终获得12.30g纯环己烯。
回答下列问题:
(1)装置b的名称是_________________。加入沸石的目的是______________。
(2)本实验分液所得产物应从 _____________倒出(填“上口”或“下口”)。
(3)提纯过程中加入Na2CO3溶液的目的是_________________
加入无水CaCl2的作用是_________________________________。
(4)本实验所得环己烯的产率是______________________ (产率= ×100%)
×100%)
化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种气体的成分是(填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为:。
(2)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(3)将实验(2)产生的刺激性气味的气体通入氯水中,可以看到氯水褪色,说明这种气体具有性;请写出该反应的化学方程式:。
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇为主要原料制备环己烯.
已知:
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
熔点(℃) |
|
| 环乙醇 |
0.96 |
25 |
161 |
难溶于水 |
| 环乙烯 |
0.81 |
﹣103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是.
②试管C置于冰水浴中的目的是.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从口进入(填“g”或“f”).收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是.