某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:
i.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色) + nH2O  [Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
[Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
ii.[FeCl4(H2O)2]-为黄色。
进行实验:
【实验I】

【实验II】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。


图1 图2
Fe(NO3)3溶液透光率随温度变化曲线 FeCl3溶液透光率随温度变化曲线
(1)实验I中,试管②溶液变为无色的原因是 。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是 。
(3)由实验II图1、2可知:加热时,溶液颜色 (填“变浅”、“变深”或“不变”)。
(4)由实验II,可以得出如下结论:
[结论一] FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]- + 4H2O  [Fe(H2O)6]3+ + 4Cl-,得出此结论的理由是 。
[Fe(H2O)6]3+ + 4Cl-,得出此结论的理由是 。
[结论二] 结论一中反应的ΔH (填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液, (请描述必要的实验操作和现象)。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。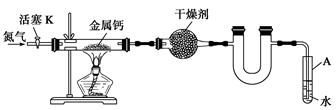
(1)反应过程中末端导管必须始终插入试管A的水中,目的是_____________________。
(2)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________________________________________________;
④拆除装置,取出产物。
(3)数据记录如下:(假设反应完全)
| 空硬质管质 量m0/g |
硬质管与钙的 质量m1/g |
硬质管与产物 的质量m2/g |
| 14.80 |
15.08 |
15.15 |
① 计算得到实验式CaxN2,其中x=________。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
______________________________________________________________________。
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下: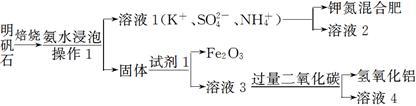
请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是____________。
(2)由溶液3制取氢氧化铝的离子方程式为。
(3)请你写出验证溶液1中有NH4+的实验过程:_______________________________________________。
(4)实验室用Fe2O3与CO反应来制取单质Fe。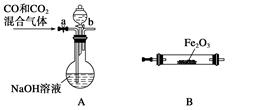
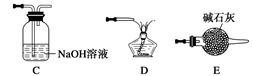
①请按气流由左到右的方向连接下列各装置,顺序为A→。
②检查装置A气密性的方法是。
③在点燃B处的酒精灯前,应进行的操作是_______________________________________;④装置C的作用是________________。
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: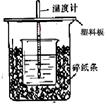
(1)从实验装置上看,图中尚缺少的一种玻璃用品_____ ___。
(2)烧杯间填满碎纸条的作用是___________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”、“无“影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”、“不相等”),所求中和热(填“相等”、“不相等”),简述理由。
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
(2)经计算,需浓H2SO4的体积为mL(保留一位小数)。现有①10 mL②50 mL③100 mL三种规格的量筒,你选用的量筒是(填代号)
(3)在配制过程中,其他操作都准确,下列操作中:错误的是,能引起实验结果偏高的有(填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.500 g。
步骤II将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时现象:__________________________________________________。
(2)滴定结果如下表所示:
| 滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。