已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中不正确的是
A.A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B.A、B、C中三种元素形成的化合物所属物质类别一定不是碱
C.如果E溶液是一种强酸,则E溶液为盐酸
D.A、B、C中有一种金属且为A
对于可逆反应2AB3(g) A2(g)+3B2(g);ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是
A2(g)+3B2(g);ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是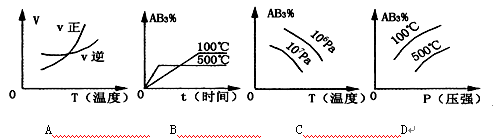
右图表示反应X(g)  4Y g)+Z g);△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是()
4Y g)+Z g);△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是()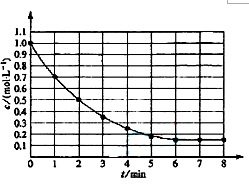
| A.第6min后,反应就终止了 |
| B.若降低温度,v正和v逆将以同样倍数减小 |
| C.X的平衡分解率为85% |
| D.若升高温度,.X的平衡分解率为85% |
已知:C(s)+CO2(g) 2CO(g) △H>0。反应达到平衡后,下列条件有利于反应向正方向进行的是 ()
2CO(g) △H>0。反应达到平衡后,下列条件有利于反应向正方向进行的是 ()
| A.升高温度和减小压强 |
| B.降低温度、减小压强和加催化剂 |
| C.降低温度和增大压强 |
| D.升高温度和增大压强 |
关于反应:①2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l);ΔH=-2600kJ/mol
②2CO(g)+O2(g) 2CO2(g);△H=-566kJ/mol
2CO2(g);△H=-566kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g);ΔH="+216" kJ/mol。下列叙述正确的是( )
CO(g)+3H2(g);ΔH="+216" kJ/mol。下列叙述正确的是( )
| A.CO的燃烧热为-566kJ/mol |
| B.在③反应时,若加入催化剂,可以使ΔH减小 |
| C.若有3.2g CH4与足量水蒸气按③反应,则放出热量是43.2 kJ |
| D.若生成相同质量的CO2,则放出的热量C2H2大于CO |
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol;Br-Br:200kJ/mol;H-Br:369kJ/mol。下列说法正确的是( )
| A.H2与Br2反应的热化学方程式为:H2(g)+Br2(g)===2HBr(g) ΔH=-102kJ |
| B.2 L HBr(g)分解成1 L H2(g)和1 L Br2(g)吸收102 kJ的热量 |
| C.1 mol H2(g)与1 mol Br2(l)反应生成2 mol HBr(g)放出的热量大于102 kJ |
| D.在相同条件下,1 mol H2(g)与1 mol Br2(g)的能量总和大于2 mol HBr(g)的能量 |