铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药物,右图是它的说明书: 
该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用最灵敏的检验试剂为_______(填试剂的名称)。
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为:_____________________________。
(3)称量上述含铁元素质量分数为20.00%的“速力菲”20.00g,将其全部溶于稀硫酸中,配制成1 000.00mL溶液.取出20.00mL,用0.01mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如下图所示。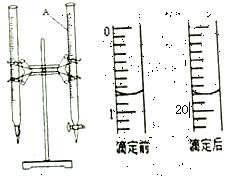
①仪器A的名称是________:由上图可知消耗KMnO4溶液体积为_________ mL;
②滴定终点观察到的现象为______________________________;
③以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是________。
| A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出 |
| B.滴定前俯视,滴定后仰视(标准液) |
| C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁 |
| D.未用标准KMnO4溶液润洗滴定管 |
④该药品可以服用吗?_____(填“可以”或“不可以”)
甲醇是一种可再生能源,具有广泛的开发和应用前景。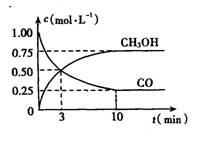
(1)工业上一般采用如下反应合成甲醇:
CO(g)+2H2(g)CH2O H(g)△H= xkJ/mo①右图是反应时CO和CH3 0H的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=____。
②下表所列数据是该反应在不同温度下的化学平衡
常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断x0(填“<”、“<”填“=”)
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
c(CO)=0.2mol/L,则CO的转化率为____。
(2)已知在常温常压下
①2CH3OH(1)+3O2(g)2CO2(g)+4H2O(g)△H=—1275.6kJ/mol
②2CO(g)+O2(g)2CO2(g)△H=—566.0kJ/mol
③H2O(g)H2O(1)△H=—44.0kJ/mol
请计算1mol甲醇不完全燃烧生成lmolCO和液态水放出的热量为____。
(3)利用甲醇燃料电池设计如右图所示的装置:
则该装置中b为____极;Cu极的电极反应式为____。
当铜片的质量变化为25.6g时,a极上消耗的O2在标准状况下的体积为___L。
黄铁矿在高温时和氧气反应生成氧化铁和二氧化硫。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]:测定硫元素的含量
I.将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的硬质玻璃管D中,A中的试剂是双氧水。从A中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的黄铁矿样品至反应完全。
Ⅱ.反应结束后,将E瓶中的溶液进行如下处理: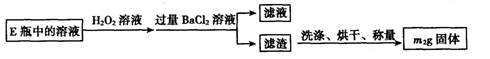
[实验二]测定铁元素的含量。
Ⅲ,测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解硬质玻璃管D中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL。
请完成下列问题:
(1)仪器B中发生反应的化学方程式是:____;仪器C中装入的试剂是____。E瓶的作用是____。
(2)Ⅱ中所加H2O2溶液需足量的理由是____;写出加入H2O2发生反应的离子方程式____。
(3)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有;④中量取稀释液25.00mL需用的仪器是____。
(4)该黄铁矿中硫元素的质量分数为____(用含m1和m2的代数式表示);该黄铁矿中铁元素的质量分数为____(用含m1 c、y的代数式表示)
已知X为一种盐,A、C、D、F为无色气体,B常温常压下为无色无味的液体,I和Y为中学化学常见的单质,其中Y为气体,I为紫红色固体,E为黑色固体氧化物,L为蓝色沉淀。其中有些反应的条件及部分生成物被略去。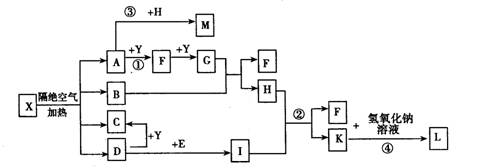
回答下列问题:
(1)写出C的电子式,L的化学式。
(2)写出反应①的化学反应方程式____;反应①一④中属于氧化还原反应的是。
(3)写出反应②的离子反应方程式____。
(4)M的水溶液呈酸性,其原因为(用离子方程式表示)____。
(5)利用电解可提纯I物质,在该电解反应中电解质溶液是____;写出阴极的电极反应式____。
(6)已知1 mol X在隔绝空气条件下分解产生的各产物的物质的量之比为A:B:C:D=2:1:1:1请推测A的化学式为____。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。
请回答下列问题:
(1)电池的负极材料为,发生的电极反应为;
(2)电池正极发生的电极反应为;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为;
(4)组装该电池必须在无水、无氧的条件下进行,原因是。
“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1∶1。已知1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学反应方程式:_____________________,
若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量_______890 kJ(填“>”、“=”或“<”)。
(2)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为_______;燃烧生成的CO2的质量比约为_______。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是___________。