下列对化学平衡移动的分析中,不正确的是 ( )
(1)已达平衡的反应

 ,当增加反应物物质的量时,平衡一定向正反应方向移动
,当增加反应物物质的量时,平衡一定向正反应方向移动
(2)已达平衡的反应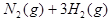

 ,当增大
,当增大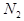 的浓度时,平衡向正反应方向移动,
的浓度时,平衡向正反应方向移动,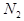 的转化率一定升高
的转化率一定升高
(3)有气体参加的反应达平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
(4)有气体参加的反应达平衡后,在恒压反应器中充入稀有气体,平衡一定不移动
| A.(1)(4) | B.(1)(2)(3) |
| C.(2)(3)(4) | D.(1)(2)(3)(4) |
海水开发利用的部分过程如图所示。下列说法错误的是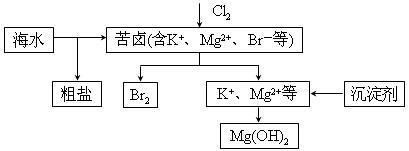
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是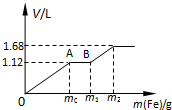
| A.开始时产生的气体为H2 |
| B.AB段发生的反应为置换反应 |
| C.所用混合溶液中c(HNO3)=0.5 mol/L |
| D.参加反应铁粉的总质量m2=5.6g |
水热法制备Fe3O4纳米级颗粒的反应为3Fe2+ +2S2O32-+O2 +xOH-=Fe3O4+S4O62-+2H2O,下列说法中,不正确的是
| A.每生成1mol Fe3O4,反应转移的电子总数为4mol |
| B.Fe2+和S2O32-都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.x=4 |
下列离子方程式正确的是
| A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
| B.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O |
| C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ |
| D.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
用右图所示装置进行下列实验,将①中溶液滴入②中,预测的现象与实际相符的是
| 选项 |
①中物质 |
②中物质 |
预测②中的现象 |
| A. |
稀盐酸 |
碳酸钠与氢氧化钠的混合溶液 |
立即产生气泡 |
| B. |
草酸溶液 |
高锰酸钾酸性溶液 |
溶液逐渐褪色 |
| C. |
氯化铝溶液 |
浓氢氧化钠溶液 |
产生大量白色沉淀 |
| D. |
浓硝酸 |
用砂纸打磨过的铝条 |
产生红棕色气体 |