CO和NO对环境影响较大,属于当今社会热点问题。请回答下列问题
(1)降低汽车尾气的反应:2NO(g)+2CO(g) N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________
N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________
(2)若在一定温度下,将1.4molNO、1.2molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示
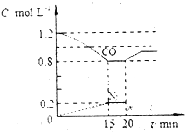
①该反应的平衡常数K=___________
②若保持温度不变,20min时再向容器中冲入CO、N2各0.8mol,平衡将向_______移动(填“向左”“向右”或“不”)
③20min时,若改变反应条件,导致CO浓度发生如图所示的变化,则改变的条件可能 是_______(填序号)
a.缩小容器体积 b.增加CO2的量 c.升高温度 d.加入催化剂
(3)固氮是科学家致力研究的重要课题,自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是______________。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.K越大说明合成氨反应的速率越大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.模拟大气固氮应用于工业上的意义不大
下列是有机化合物A的转化过程: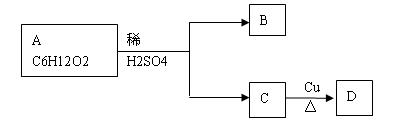
(1)若D在一定条件可以氧化为B,则A的结构简式:_______________________ 。
(2)若有 X、Y两物质与A是同类物质的同分异构体,也能发生上述转化。
①若B能发生银镜反应;C不能发生消去反应,则X的结构简式___________;
②若B,D均不能发生银镜反应;则Y的可能的结构简式_______________。
(3)若 Z与A为不同类别同分异构体,并且具有下列性质:
①Z不能与NaHCO3溶液反应;②Z不能使溴水褪色;
③1摩尔Z与足量金属钠反应可以生成1摩尔H2;
④Z分子的一氯取代产物只有二种(不考虑立体异构现象)。
则Z的结构简式_____________________ 。
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式:2NO+2CO 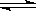 2CO2+N2;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/ mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应是________ 反应(填写“吸热”、“放热”)。
(2)前2s内的平均反应速度v(N2)=________。
(3)此反应的平衡常数表达式为K=________。
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A .选用更有效的催化剂 B.升高反应体系的温度
.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4。
(1)请将NaBiO3之外的反应物与生成物分别填入以下空格内。
(2)反应中,被氧化的元素是____________,氧化剂是___________。
(3)将氧化剂与还原剂及其已配平的化学计量数填入 下列空格中,并标出电子转移的方向和数目。
下列空格中,并标出电子转移的方向和数目。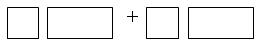
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是人体内含量最高的金属元素。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的非金属性由强到弱的顺序为。
(2)B的氢化物的分子空间构型是______________ 。它是__________(填极性和非极性)分子。
(3)写出化合物AC2的电子式________;一种由B、C组成的化合物与AC2电子数相等,其化学式为_________________ 。
(4)E的核外电子排布式是________________。
(5)10molB的最高价氧化物对应的水化物的稀溶液与4molD的单质反应时,B被还原到最低价,B被还原后的产物化学式为____________。
黄酮醋酸类化合物具有黄酮类化合物抗菌、消炎、降血压、保肝等多种生理活性和药理作用,尤其是近年来报道此类化合物具有独特抗癌活性。下面的方法采用对甲酚作为起始原料,通过一系列反应合成化合物黄酮F(化学式为C18H12O2NBr),为黄酮醋酸的前体化合物)。其进一步水解即得黄酮醋酸。合成路线如下:
A是酯;F分子中存在3个六元环,E和F在化学式上相差2个H原子。
已知①RCH2Cl+HCN发生取代生成RCH2CN,RCH2CN进一步水解得RCH2COOH;②由于溴苯的溴原子参与苯环的共轭,溴苯在强碱性溶液中水解过程十分困难,需要在高温(300℃)、以铜离子作催化剂的条件下进行。
⑴ 请画出A、D、F的结构简式:A、D、F;
⑵ B有多种同分异构体,请写出一种含苯环且苯环上二元取代、含有醛基且能使FeCl3溶液变紫色的同分异构体: 。
⑶ A可能发生的化学反应的类型有。(写出二种)
⑷ 写出化合物 与新制的Cu(OH)2强碱性悬浊液共热至573K时发生反应的化学方程式。
与新制的Cu(OH)2强碱性悬浊液共热至573K时发生反应的化学方程式。
⑸ D经过水解后的产物可通过缩聚反应生成高分子化合物,写出该缩聚反应的方程式。