物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )。
| A.Ba(OH)2、Na2S03、FeCl3、KCl |
| B.Na2Si03、Na2C03、KN03、NH4Cl |
| C.NH3·H20、H3P04、Na2S04、H2S04 |
| D.HCl、CH3COOH、C2H5OH、Na2SiO3 |
下列叙述正确的是()
| A.元素的相对原子质量是小数,是由于元素具有同位素 |
| B.有相同质子数的原子或离子一定属于同种元素 |
| C.K+和Ar具有相同的电子层结构,氧化性K+比Ar强 |
| D.金属离子的电子层数一定比金属原子的电子层数少 |
锎是锕系中的一种元素,1 mg锎( )每秒钟约能释放出2.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关说法错误的是()
)每秒钟约能释放出2.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关说法错误的是()
| A.锎位于元素周期表第6周期 |
B. 和 和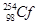 互为同位素 互为同位素 |
C. 中,质子数和电子数均为98 中,质子数和电子数均为98 |
D. 的中子数与质子数之差为56 的中子数与质子数之差为56 |
将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是,可能有的阳离子是。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是,可能含有的阳离子是。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为。
a mol FeS与b mol FeO投入到V L、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为()
①(a+b)×63 g②(a+b)×189 g③(a+b)mol④[Vc-(9a+b)/3]mol
| A.①④ | B.②③ | C.①③ | D.②④ |
把a L含(NH4)2SO4和NH4NO3的混合液分成2等份,一份用b mol的NaOH刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol的BaCl2,则原溶液中c(NO3-)为()
| A.(b-2c)/a mol·L-1 | B.(2b-4c)/a mol·L-1 |
| C.(2b-c)/a mol·L-1 | D.(b-2c)/2a mol·L-1 |