以下各组离子中,在pH=13.0的溶液中能大量共存的是
| A.Na+、K+、Cl-、AlO2- | B.Ba2+、NO3-、HCO3-、Br- |
| C.Cu2+、K+、S2-、SO42- | D.K+、SO32-、NO3-、MnO4- |
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
下列措施不能达到节能减排目的的是
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
C.利用潮汐能发电  |
D.用节能灯代替白炽灯 |
某溶液中Cl-、Br-、I-三者物质的量之比是2∶3∶4,通入一定量的Cl2,该比值为1∶1∶1,则反应的Cl2和原溶液中I-的物质的量之比是
| A.1∶2 | B.1∶4 | C.1∶6 | D.1∶8 |
对下列有机反应类型的认识中,错误的是
A.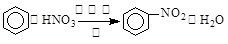 :取代反应 :取代反应 |
| B.CH2=CH2+Br2 →CH2BrCH2Br :加成反应 |
C.2CH3CHO+O2  2CH3COOH:氧化反应 2CH3COOH:氧化反应 |
D.CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O :加成反应 CH3COOCH2CH3+H2O :加成反应 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.11.2 L氧气中所含有的原子数为NA |
| B.同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 |
| C.物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA |
| D.54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |