设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.标准状况下,22.4 L CCl4中所含分子数为NA |
| B.标准状况下,18g水所含原子数为NA |
| C.常温常压下,11.2 LCO2所含的原子数为1.5NA |
| D.常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |
下列化学用语书写正确的是
| A.氮气分子的结构式:N≡N |
B.高氯酸的分子式: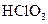 |
C.氯化镁的电子式: |
D.用电子式表示氯化氢分子的形成过程: |
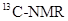 (核磁共振)可用于含碳化合物的结构分析
(核磁共振)可用于含碳化合物的结构分析 N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关。
N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关。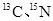 叙述正确的是
叙述正确的是
A.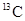 与砖 与砖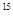 N具有相同的中子数 N具有相同的中子数 |
B.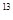 C与 C与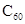 是同一种物质 是同一种物质 |
C.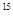 N与 N与 N互为同位素 N互为同位素 |
D.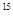 N的核外电子数与中子数相同 N的核外电子数与中子数相同 |
下列说法正确的是()
| A.淀粉的特征反应是常温下遇到KI溶液变蓝 |
| B.葡萄糖溶液中加入新制的Cu(OH)2悬浊液煮沸,会析出砖红色沉淀 |
| C.纤维素、淀粉都可用(C6H10O5)n表示,它们互为同分异构体 |
| D.油脂在酸性条件下的水解反应称为皂化反应,常用此反应制取肥皂 |
下列叙述中能肯定A元素的金属性比B元素的金属性强的是()
| A.A原子的最外层电子数比B原子的最外层电子数少 |
| B.A原子的电子层数比B原子的电子层数多 |
| C.1molA单质从酸中置换出的H2比1molB单质从酸中置换出的H2多 |
| D.常温时,A单质能从水中置换出氢,而B单质则不能 |
某烃的结构简式为 ,它可能具有的性质是()
,它可能具有的性质是()
| A.它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 |
| B.它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 |
| C.易溶于水,也易溶于有机溶剂 |
| D.能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成 |