实验:①0.1 mol•L-1AgNO3溶液和0.1 mol•L-1NaCl溶液等体积混合得到浊液,过滤。②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是
| A.实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- |
| B.由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
| C.实验的③溶液中含有[Ag(NH3)2]+微粒 |
| D.实验②证明了该温度下Ag2S比Ag2SO4更难溶解 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液:Fe2+、K+、HSO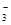 、ClO- 、ClO- |
B.0.1 mol·L-1FeCl3溶液:NH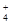 、H+、I-、SCN- 、H+、I-、SCN- |
C.0.1 mol·L-1Na2CO3溶液:K+、Ca2+、HCO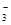 、SO 、SO |
D.使酚酞变红色的溶液:Na+、Ba2+、NO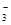 、Cl- 、Cl- |
下列有关化学用语表示正确的是( )
A.甲基的电子式: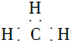 |
B.镁离子的结构示意图: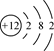 |
C.质量数为34、中子数为18的核素: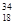 S S |
D.乙酸的结构简式: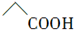 |
化学与生活、生产、环境等社会实际密切相关。下列叙述正确的是( )
| A.稀的食盐水能杀死H7N9禽流感病毒 |
| B.涤纶、塑料、光导纤维都是有机高分子材料 |
| C.用电镀厂的废水直接灌溉农田,可提高水的利用率 |
| D.外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。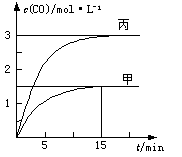
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
V |
| 温度 |
T1 ℃ |
T2 ℃ |
T1 ℃ |
| 起始量 |
2 molC 1 molH2O |
1 molCO 1 molH2 |
4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)="0.1" mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)="0.4" mol,则T1< T2
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+)